1、选择题 在镁与稀硫酸的反应中,已知10s末硫酸的浓度减少了0.6 mol/L,则10s内生成氢气的平均反应速率是
[? ]
A.0.06mol/L·s
B.1.8mol/L·s
C.1.2mol/L·s
D.0.18mol/L·s
参考答案:A
本题解析:
本题难度:简单
2、计算题 下图装置中,容器甲内充入0.1 mol NO气体,干燥管内装有一定量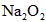 ,从A处缓慢通入
,从A处缓慢通入 气体.恒温下,容器甲中活塞缓慢由B向左移动,当移至C处时容器体积缩小至最小,为原体积的
气体.恒温下,容器甲中活塞缓慢由B向左移动,当移至C处时容器体积缩小至最小,为原体积的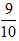 ,随着
,随着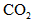 的继续通入,活塞又逐渐向右移动。
的继续通入,活塞又逐渐向右移动。
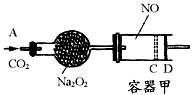
(1)已知当活塞移至C处时,干燥管中物质的质量增加了2.24 g.此时,通入标准状况下的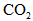 气体多少L?容器甲中
气体多少L?容器甲中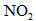 转化为
转化为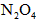 的转化率是多少?
的转化率是多少?
(2)活塞移至C处后,继续通入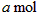
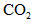 ,此时活塞恰好回至B处.则a值必小于0.01,其理由是__________________________________________.
,此时活塞恰好回至B处.则a值必小于0.01,其理由是__________________________________________.
(3)若改变干燥管中 的量,要通过调节甲容器的温度及通入
的量,要通过调节甲容器的温度及通入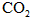 的量,使活塞发生从B到C,又从C到B的移动,则
的量,使活塞发生从B到C,又从C到B的移动,则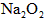 的质量最小值应大于________g.
的质量最小值应大于________g.
参考答案:(1)1.792L;25%
(2)当活塞由C向B移动时,因体积扩大使平衡: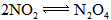 向体积扩大方向移动以至混合气体物质的量增大.增大的物质的量可由下式求出
向体积扩大方向移动以至混合气体物质的量增大.增大的物质的量可由下式求出
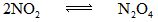
起始:0.08 mol 0
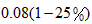
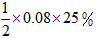
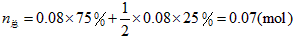
因平衡时混合气体总的物质的量为0.07 mol,由于活塞由C移至B,体积扩大,故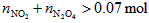 ,可知充入
,可知充入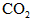 物质的量必小于0.01 mol
物质的量必小于0.01 mol
(3)1.56
本题解析:
本题难度:一般
3、选择题 可逆反应2SO2+O2 2SO3,正反应速率分别用v(SO2)、v(O2)、v(SO3)(mol·L-1·min-1)表示,逆反应速率分别用v′(SO2)、v′(O2)、v′(SO3)(mol·L-1·min-1)表示,当反应达到化学平衡时,正确的关系是
2SO3,正反应速率分别用v(SO2)、v(O2)、v(SO3)(mol·L-1·min-1)表示,逆反应速率分别用v′(SO2)、v′(O2)、v′(SO3)(mol·L-1·min-1)表示,当反应达到化学平衡时,正确的关系是
①v(SO2)=v′(SO2)
②v(O2)=v′(SO2)=v(SO3)
③v(O2)= v′(SO2)
v′(SO2)
④v′(SO2)=v′(O2)=v′(SO3)
A.①②③④
B.①②③
C.②③④
D.①③
参考答案:D
本题解析:根据化学反应速率判断一个反应是否达到化学平衡的标志是:v正=v逆。对于反应2SO2(g)+O2(g) 2SO3(g)达到化学平衡时,v(SO2)=2v(O2)=v(SO3)=v′(SO2)=2v′(O2)=v′(SO3)。
2SO3(g)达到化学平衡时,v(SO2)=2v(O2)=v(SO3)=v′(SO2)=2v′(O2)=v′(SO3)。
本题难度:一般
4、选择题 相同温度下,体积均为0.25?L的两个恒容密闭容器中发生可逆反应:N2(g)+3H2(g) 2NH3(g)?△H=-92.6kJ/moL。实验测得起始、平衡时得有关数据如下表
2NH3(g)?△H=-92.6kJ/moL。实验测得起始、平衡时得有关数据如下表

下列叙述错误的是?
[? ]
A.容器①、②中反应的平衡常数相等?
B.平衡时,两个容器中NH3的体积分数均为1/7
C.容器②中达平衡时放出的热量Q=23.15?kJ
D.若容器①体积为0.5L,则平衡时放出的热量<23.15kJ
参考答案:C
本题解析:
本题难度:一般
5、选择题 在一定温度下,恒容密闭容器中,充入一定量的NO和O2,发生2NO+ O2 2NO2,反应达到平衡的标志是
2NO2,反应达到平衡的标志是
① NO、O2、NO2分子数目比是2:1:2?②反应混合物中各组分物质的浓度相等
③混合气体的颜色不再改变?④混合气体的密度不再改变
⑤混合气体的平均相对分子质量不再变化?⑥?υc(O2)(正) = υ c(NO2)(逆)=1:2
A.②
B.①②
C.②③④
D.③⑤⑥
参考答案:D
本题解析:在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态。颜色深浅和浓度有关系,所以③正确;平衡时浓度不再发生变化,但物质之间的浓度不一定相等或满足某种关系,①②不正确;密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,④不正确;混合气的平均相对分子质量是混合气的质量和混合气的总的物质的量的比值,质量不变,但物质的量是变化的,⑤可以说明;⑥中反应速率的方向相反,且满足速率之比是相应的化学计量数之比,正确,答案选D。
本题难度:一般