1、选择题 在镁与稀硫酸的反应中,已知10s末硫酸的浓度减少了0.6 mol/L,则10s内生成氢气的平均反应速率是
[? ]
A.0.06mol/L·s
B.1.8mol/L·s
C.1.2mol/L·s
D.0.18mol/L·s
2、计算题 下图装置中,容器甲内充入0.1 mol NO气体,干燥管内装有一定量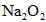 ,从A处缓慢通入
,从A处缓慢通入 气体.恒温下,容器甲中活塞缓慢由B向左移动,当移至C处时容器体积缩小至最小,为原体积的
气体.恒温下,容器甲中活塞缓慢由B向左移动,当移至C处时容器体积缩小至最小,为原体积的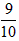 ,随着
,随着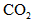 的继续通入,活塞又逐渐向右移动。
的继续通入,活塞又逐渐向右移动。
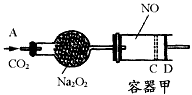
(1)已知当活塞移至C处时,干燥管中物质的质量增加了2.24 g.此时,通入标准状况下的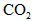 气体多少L?容器甲中
气体多少L?容器甲中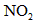 转化为
转化为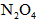 的转化率是多少?
的转化率是多少?
(2)活塞移至C处后,继续通入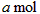
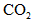 ,此时活塞恰好回至B处.则a值必小于0.01,其理由是__________________________________________.
,此时活塞恰好回至B处.则a值必小于0.01,其理由是__________________________________________.
(3)若改变干燥管中 的量,要通过调节甲容器的温度及通入
的量,要通过调节甲容器的温度及通入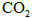 的量,使活塞发生从B到C,又从C到B的移动,则
的量,使活塞发生从B到C,又从C到B的移动,则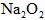 的质量最小值应大于________g.
的质量最小值应大于________g.
3、选择题 可逆反应2SO2+O2 2SO3,正反应速率分别用v(SO2)、v(O2)、v(SO3)(mol·L-1·min-1)表示,逆反应速率分别用v′(SO2)、v′(O2)、v′(SO3)(mol·L-1·min-1)表示,当反应达到化学平衡时,正确的关系是
2SO3,正反应速率分别用v(SO2)、v(O2)、v(SO3)(mol·L-1·min-1)表示,逆反应速率分别用v′(SO2)、v′(O2)、v′(SO3)(mol·L-1·min-1)表示,当反应达到化学平衡时,正确的关系是
①v(SO2)=v′(SO2)
②v(O2)=v′(SO2)=v(SO3)
③v(O2)= v′(SO2)
v′(SO2)
④v′(SO2)=v′(O2)=v′(SO3)
A.①②③④
B.①②③
C.②③④
D.①③
4、选择题 相同温度下,体积均为0.25?L的两个恒容密闭容器中发生可逆反应:N2(g)+3H2(g) 2NH3(g)?△H=-92.6kJ/moL。实验测得起始、平衡时得有关数据如下表
2NH3(g)?△H=-92.6kJ/moL。实验测得起始、平衡时得有关数据如下表

下列叙述错误的是?
[? ]
A.容器①、②中反应的平衡常数相等?
B.平衡时,两个容器中NH3的体积分数均为1/7
C.容器②中达平衡时放出的热量Q=23.15?kJ
D.若容器①体积为0.5L,则平衡时放出的热量<23.15kJ
5、选择题 在一定温度下,恒容密闭容器中,充入一定量的NO和O2,发生2NO+ O2 2NO2,反应达到平衡的标志是
2NO2,反应达到平衡的标志是
① NO、O2、NO2分子数目比是2:1:2?②反应混合物中各组分物质的浓度相等
③混合气体的颜色不再改变?④混合气体的密度不再改变
⑤混合气体的平均相对分子质量不再变化?⑥?υc(O2)(正) = υ c(NO2)(逆)=1:2
A.②
B.①②
C.②③④
D.③⑤⑥