1、选择题 已知25℃时,Ka(HF)=3.6×10-4,Ksp(CaF2)=1.46×10-10。现向1 L 0.2 mol·L-1 HF溶液
中加入1 L 0.2 mol·L-1 CaCl2溶液,则下列说法中,正确的是? ( ? )
A.25℃时,0.1 mol·L-1 HF溶液中pH=1
B.Ksp(CaF2)随温度和浓度的变化而变化
C.该体系中没有沉淀产生
D.该体系中HF与CaCl2反应产生沉淀
参考答案:D
本题解析:现向lL0.2 mol·L-1HF溶液中加入1L0.2 mol·L-1CaCl2溶液,则此时c(F-)×c(H+)/c(HF)=3.6×10-4,所以c(F-)=c(H+)=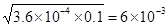 mol/L。由于c(Ca2+)=0.1mol·L-1,则此时c(F-)×c(F-)×c(Ca2+)=3.6×10-6>1.46×10-10,所以必然会析出CaF2,D正确,A和C不正确。溶度积常数和浓度没有关系,只与温度有关系,B不正确,答案选D。
mol/L。由于c(Ca2+)=0.1mol·L-1,则此时c(F-)×c(F-)×c(Ca2+)=3.6×10-6>1.46×10-10,所以必然会析出CaF2,D正确,A和C不正确。溶度积常数和浓度没有关系,只与温度有关系,B不正确,答案选D。
点评:该题是中等难度的试题,也是高考中的常见考点和题型。试题贴近高考,综合性强,有利于培养学生的严谨的逻辑思维能力和发散思维能力,有助于培养学生的应试能力,提高学生的学习效率和学习积极性。
本题难度:简单
2、填空题 (14分)红磷P(s)和Cl2 (g)发生反应生成PCl3(g)和 PCl5(g),反应过程如下。
2P(s) + 3Cl2(g) = 2PCl3(g) △H=-612kJ/mol
2P(s) + 5Cl2(g) = 2PCl5(g) △H=-798kJ/mol
请回答下列问题。
(1)气态 PCl5生成气态PCl3和Cl2的热化学方程式为 。
(2)PC15生成 PCl3和Cl2是一个可逆反应,向5.0L密闭容器中充入0.1 md PCl5(g),反应在不同条件下进行,反应体系总压强随时间的变化关系如图所示。
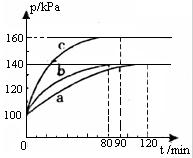

①实验b中PCl5的平衡分解率为 ,其他条件不变,在该实验中再加入 0.1 mol PCl5 (g) ,平衡分解率 (填“增大”、“减小”或“不变”)。
②与实验a相比,c改变的条件是 ,判断依据是 。
(3)PCl5露置于潮湿空气中,能水解生成两种中学化学常见酸,其化学方程式为 。
(4)人的牙齿表面有一层釉质,其组成为羟基磷灰石 Ca5( PO4)3OH(Ksp=6.8×10-37)。为了防止蛀牙,人们常使用含氟离子的牙膏,其中的氟化物可使轻基磷灰石转化为氟磷灰石Ca5( PO4)3F(Ksp=1.0×10-60)。写出该反应的离子方程式 ,该反应的平衡常数为 。
参考答案:(14分)(1)PCl5(g) 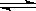 PCl3(g) + Cl2(g) △H=+93kJ/mol(2分)
PCl3(g) + Cl2(g) △H=+93kJ/mol(2分)
(2)①40% (2分) 减小(1分)
②升高温度(1分) 初始压强没变,反应速率加快且平衡正移程度变大(2分)
(3)PCl5+4H2O=H3PO4+5HCl(2分)
(4)Ca5( PO4)3OH+F-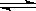 Ca5( PO4)3F+OH-(2分);6.8×10-23(2分)
Ca5( PO4)3F+OH-(2分);6.8×10-23(2分)
本题解析:(1)根据盖斯定律,用上式减去下式后除以2,可得到所求热化学方程式,所以气态 PCl5生成气态PCl3和Cl2的热化学方程式为PCl5(g) 3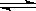 PCl3(g) + Cl2(g) △H=+93kJ/mol;
PCl3(g) + Cl2(g) △H=+93kJ/mol;
(2)①开始体系的压强为100kPa,平衡时,为140kPa,压强增大为原来的1.4倍,则气体的物质的量增大到原来的1.4倍,设PCl5的物质的量减少xmol,则生成氯气和三氯化磷的物质的量均是xmol,所以0.1-x+x+x=0.1×1.4,解得x=0.04mol,所以PCl5的分解率为0.04mol/0.1mol×100%=40%;其他条件不变,在该实验中再加人 0.1 mol PCl5 (g),相当于减小容器的体积,压强增大,平衡逆向移动, 则五氯化磷的分解率减小;
②c与a比,平衡时的压强增大,达到平衡的时间变短,说明平衡正向移动,同时反应速率加快,所以改变的条件是升高温度;判断的依据是初始压强没变,反应速率加快且平衡正移程度变大;
(3)根据元素守恒判断五氯化磷水解生成的两种酸为磷酸和HCl,化学方程式是PCl5+4H2O=H3PO4+5HCl;
(4)氟化物可使羟基磷灰石转化为氟磷灰石,因为氟磷灰石比羟基磷灰石更难溶,且该反应是可逆反应,离子方程式是Ca5( PO4)3OH+F-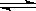 Ca5(PO4)3F+OH-;该反应的平衡常数=6.8×10-37/(1.0×10-60)= 6.8×10-23。
Ca5(PO4)3F+OH-;该反应的平衡常数=6.8×10-37/(1.0×10-60)= 6.8×10-23。
考点:考查盖斯定律的应用,化学平衡的应用,沉淀的转化
本题难度:困难
3、选择题 把Ca(OH)2放入蒸馏水中,一段时间后达到平衡:Ca(OH)2(s)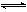 Ca2++2OH-
Ca2++2OH-
当向悬浊液中加入少量生石灰后,若温度保持不变,下列说法正确的是(?)?
A.溶液中Ca2+数目增多
B.溶液中Ca2+数目不变
C.c(Ca2+)增大
D.c(Ca2+)不变
参考答案:D
本题解析:把Ca(OH)2放入蒸馏水中,达到沉淀溶解平衡后,溶液即是饱和溶液,再加入生石灰,反应消耗水,则原溶液会析出一部分氢氧化钙固体,Ca2+数目减少,但溶液还是饱和溶液,各微粒的浓度不变。故选D
本题难度:一般
4、选择题 已知298 K时下列物质的溶度积(单位略)。
?
| CH3COOAg
| AgCl
| Ag2CrO4
| Ag2S
|
Ksp
| 2.3×10-3
| 1.77×10-10
| 1.12×10-12
| 6.7×10-15
|
?
下列说法正确的是
A.等体积、浓度均为0.02 mol·L-1的CH3COONa和AgNO3溶液混合能产生沉淀
B.向含有浓度均为0.01 mol·L-1的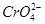 和Cl-的溶液中慢慢滴入AgNO3溶液时,
和Cl-的溶液中慢慢滴入AgNO3溶液时,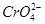 先沉淀
先沉淀
C.在CH3COOAg悬浊液中加入盐酸时发生反应的离子方程式为CH3COOAg+H++Cl-=CH3COOH+AgCl
D.298 K时,上述四种饱和溶液的物质的量浓度:
c(CH3COOAg)>c(AgCl)>c(Ag2CrO4)>c(Ag2S)
参考答案:C
本题解析:Ksp(CH3COOAg)>Ksp(AgCl),向CH3COOAg悬浊液中加入盐酸时CH3COOAg转化为AgCl,离子方程式为CH3COOAg+H++Cl-=CH3COOH+AgCl,C正确。
本题难度:一般
5、选择题 在25 ℃时,FeS的Ksp=6.3×10-18,CuS的Ksp=1.3×10-36,ZnS的Ksp=1.3×10-24。下列有关说法中正确的是
A.25 ℃时,CuS的溶解度大于ZnS的溶解度
B.25 ℃时,饱和CuS溶液中Cu2+的浓度为1.3×10-36 mol·L-1
C.向物质的量浓度相同的FeCl2、ZnCl2的混合液中加入少量Na2S,只有FeS沉淀生成
D.除去某溶液中的Cu2+,可以选用FeS作沉淀剂
参考答案:D
本题解析:对于组成相似的难溶解电解质,Ksp越大,其溶解性越大,CuS的溶解小于ZnS,A错;饱和CuS溶液中,Cu2+的浓度是Ksp1/2=(1.3×10-36)1/2,B错;相同条件下,加入S2-离子,Ksp小的先沉淀,所以Zn2+先沉淀,C错;加入FeS,可以转化为Ksp小的CuS,D正确。答案选D。
本题难度:一般