1、填空题 如图是一个电化学过程的示意图.
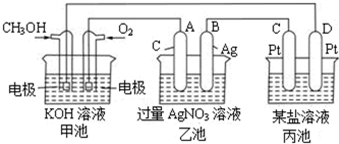
请回答下列问题:
(1)图中甲池的名称______(填“原电池”“电解池”或“电镀池”).
(2)写出通入CH3OH的电极的电极反应式:______.
(3)乙池中反应的化学方程式为______,当乙池中B极的质量增加5.4g时,甲池中理论上消耗O2的体积为______L(标准状况下),此时丙池中______电极(填“C”或“D”)析出1.6g某金属,则丙池的某盐溶液可能是______(填序号)
A.MgSO4溶液B.CuSO4溶液C.NaCl溶液D.AgNO3溶液.
参考答案:(1)甲池能自发的进行氧化还原反应,所以属于原电池,故答案为:原电池;
(2)燃料电池中,负极上通入燃料,碱性条件下,甲醇水中和氢氧根离子反应生成碳酸根离子和水,所以电极反应式为:CH3OH+8OH--6e-=CO32-+6H2O,
故答案为:CH3OH+8OH--6e-=CO32-+6H2O;
(3)乙池是电解池,碳作阳极,银作阴极,所以反应是电解硝酸银溶液,电池反应式为:4AgNO3+2H2O电解.4Ag+O2↑+4HNO3,乙池是电解池,B极上银离子得电子发生还原反应而析出银,根据转移电子相等,当乙池中B极的质量增加5.4g时,甲池中理论上消耗O2的体积=5.4g108g/mol4×22.4L/mol=0.28L,
丙池是电解池,阴极上金属离子放电析出金属单质,则金属元素在氢元素之后,D电极连接甲醇电极,所以D是阴极,根据转移电子相等知,当析出一价金属时,其摩尔质量=1.6g5.4g108g/mol=32g/mol,则该元素是硫元素,硫元素是非金属元素,所以错误,当析出的是二价金属,则
1.6g5.4g108g/mol2=64g/mol,所以该金属是铜,则溶液是硫酸铜溶液,故选B,
故答案为:4AgNO3+2H2O电解.4Ag+O2↑+4HNO3;0.28;D;B.
本题解析:
本题难度:简单
2、选择题 锌铜原电池产生电流时,阳离子( )
A.移向Zn极,阴离子移向Cu极
B.移向Cu极,阴离子移向Zn极
C.和阴离子都移向Zn极
D.和阴离子都移向Cu极
参考答案:A.Zn为负极,Cu为正极,阳离子向Cu极移动,阴离子向Zn极移动,故A错误;
B.Zn为负极,Cu为正极,阳离子向Cu极移动,阴离子向Zn极移动,故B正确;
C.Zn为负极,Cu为正极,阳离子向Cu极移动,阴离子向Zn极移动,故C错误;
D.Zn为负极,Cu为正极,阳离子向Cu极移动,阴离子向Zn极移动,故D错误;
故选B.
本题解析:
本题难度:简单
3、选择题 一种新型燃料电池,一极通入空气,另一极通入甲烷气体;电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2-.下列对该燃料电池说法正确的是(?)
A.在熔融电解质中,O2-由负极移向正极
B.在外电路,电流从甲烷所通电极流向空气所通电极
C.通入空气的一极是正极,电极反应为:O2-4e-=2O2-
D.通入甲烷的一极是负极,电极反应为: CH4-8e-+4O2-=CO2+2H2O
参考答案:D
本题解析:在原电池中负极失去电子,发生氧化反应,所以负极通入甲烷,正极通入空气,得到电子,发生还原反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,阴离子向负极移动,所以正负极的电极反应式分别是2O2+8e-=4O2-、CH4-8e-4O2-=CO2+2H2O,所以答案选D。
本题难度:一般
4、选择题 普通水泥在固化过程中自由水分子减少并产生Ca(OH)2,溶液呈碱性。根据这一特点科学家发明了电动势(E)法测水泥初凝时间,此法的原理如图所示,反应的总方程式为:2Cu+Ag2O=Cu2O+2Ag。下列有关说法不正确的是

A.工业上制备普通水泥的主要原料是黏土和石灰石
B.测量原理装置图中,Ag2O/Ag极发生氧化反应
C.负极的电极反应式为:2Cu+2OH--2e-=Cu2O+H2O
D.在水泥固化过程中,由于自由水分子的减少,溶液中各离子浓度的变化导致电动势变化
参考答案:B
本题解析:原电池中相对活泼的电极为负极,失电子,发生氧化反应,所以本电池中铜极发生氧化反应:2Cu+2OH--2e-=Cu2O+H2O,而Ag2O/Ag极做正极,发生还原反应,故选B
本题难度:一般
5、填空题 (8分)某同学在用锌与稀硫酸反应制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气生成的速率。请回答下列问题:
(1)上述实验中,发生的化学反应方程式有______________________________
(2)硫酸铜溶液加快氢气生成的速率的原因______________________________
(3)实验室现有Na2SO4、MgSO4、HgSO4、K2SO4等四种溶液,可与上述实验中CuSO4溶液起相似作用的是____________________
(4)要加快上述实验中气体生成的速率,还可以采取的措施有____________
参考答案:(1)Zn + CuSO4 = ZnSO4 + Cu Zn + H2SO4 = ZnSO4 + H2↑(各1分,共2分,方程式的先后顺序不限)(2) 置换出的铜与锌在硫酸中构成原电池,加快反应速率。(2分)
(3)HgSO4 (2分)(4)升高温度或者增加稀硫酸的浓度 (其他合理答案也可)。
本题解析:(1)因为氧化性Cu2+>H+, Zn先跟硫酸铜反应Zn+CuSO4=ZnSO4+Cu,硫酸铜反应完后再与酸反应Zn+H2SO4=ZnSO4+H2↑;(2)锌置换出铜,铜、锌和稀硫酸形成原电池,化学反应速率加快;(3)4种溶液中,能与锌发生置换反应生成金属单质的只有HgSO4;(4)对于溶液中的化学反应,要加快上述实验中气体生成的速率,还可采取升高反应温度、适当增加硫酸的浓度、增加锌粒的表面积等。
考点:考查化学反应速率的影响因素。
本题难度:一般