1、填空题 下表为长式周期表的一部分,其中的编号代表对应的元素。
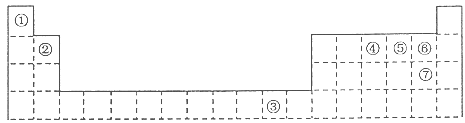
(1)元素③基态原子的电子排布式为?。
(2)②与⑦形成的化合物的空间构型为?。
(3)元素②④⑤⑥的第一电离能由大到小的顺序是?(填元素符号)
(4)在测定①与⑥形成化合物的相对分子质量时,实验测得的值一般高于理论值的主要原因?。
(5)胆矾CuSO4·5H2O可写成[Cu(H2O)4]SO4·H2O,其结构如图所示。下列说法正确的是?
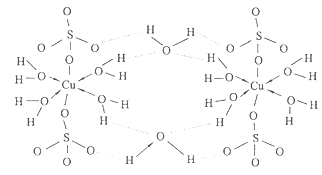
a.在上述结构示意图中,所有氧原子都采用sp3杂化
b.在上述结构示意图中,存在配位键、共价键和离子键
c.胆矾是分子晶体,分子间存在氢键
d.胆矾中的水在不同温度下会分步失去
(6)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是?。
参考答案:(1)1s22s22p63s23p63d104s1;
(2)直线型;
(3)F>N>O>Be;
(4)因为HF分子在气相时会通过氢键二聚或多聚,导致实测相对分子质量偏大;
(5)bd;
(6)N、F、H三种元素的电负性:F>N>H,在NF3中,共用电子对偏向F,偏离N原子使得氮原子上的孤对电子难于与Cu2+形成配位键。
本题解析:根据元素周期表的结构及常见元素在元素周期表中的位置判断,①为氢元素,②为铍元素,③为铜元素,④为氮元素,⑤为氧元素,⑥为氟元素,⑦为氯元素。(1)元素③为铜元素,基态原子的电子排布式为1s22s22p63s23p63d104s1;(2)根据价层电子对互斥理论判断,②与⑦形成的化合物BeCl2的空间构型为直线型;(3)根据同周期元素性质递变规律判断:同周期由左向右第一电离能呈递增趋势,但氮元素原子最外层p轨道为半充满状态,较稳定,第一电离能比相邻的氧元素大,元素②④⑤⑥的第一电离能由大到小的顺序是F>N>O>Be;(4)在测定①与⑥形成化合物HF的相对分子质量时,实验测得的值一般高于理论值的主要原因是因为HF分子在气相时会通过氢键二聚或多聚,导致实测相对分子质量偏大;(5)a.由题给结构判断,只有H2O中的氧原子和SO42—中的2个羟基氧为饱和氧原子,采用sp3杂化,错误;b.在上述结构示意图中,存在配位键、共价键和离子键,正确;c.胆矾是离子晶体,错误;d.胆矾中的水在不同温度下会分步失去,正确,选bd;(6)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是N、F、H三种元素的电负性:F>N>H,在NF3中,共用电子对偏向F,偏离N原子使得氮原子上的孤对电子难于与Cu2+形成配位键。
本题难度:一般
2、填空题 利用反应:Cu2Cl2+C2H2+2NH3→Cu2C2(乙炔亚铜,红色)+2NH4Cl可检验乙炔。
(1)基态时亚铜离子核外电子排布式为?。
(2)NH3中氮原子的杂化方式为?;NH4+空间构型为?(用文字描述)。
(3)乙炔分子中σ键与π键数目之比为?,与C22-互为等电子体的分子有?(写化学式,举一例)。
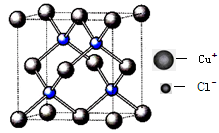
(4)氯化亚铜晶胞结构如下图,晶胞中含Cu+数目为?。
(5)合成氨工业常用铜(I)氨溶液吸收CO生成[Cu(NH3)3(CO)]+,该配离子中配体有?(写化学式)。
参考答案:(1)1s22s22p63s23p63d10或[Ar]3d10(2分)?(2)sp3(1分);正四面体(1分)
(3)3∶2(2分) ;N2或CO(2分)?(4)4(2分)?(5)NH3和CO(2分)。
本题解析:⑴根据基态铜原子的电子排布式1s22s22p63s23p63d104s1或[Ar]3d104s1,写出基态时亚铜离子核外电子排布式为1s22s22p63s23p63d10或[Ar]3d10;
⑵NH3中氮原子形成3个σ键同时有一个孤电子对,其杂化方式为sp3;NH4+中心原子氮原子形成了4个σ键,故其空间构型为正四面体;
⑶根据乙炔的结构式H-C≡C-H,可得乙炔分子中σ键与π键数目之比为3∶2;C22-属于双原子,10个价电子的微粒,与其互为等电子体的分子有N2或CO;
⑷根据氯化亚铜晶胞结构可计算晶胞中含Cu+数目为:8×1/8+6×1/2=4(个);
⑸配离子[Cu(NH3)3(CO)]+的中心原子为Cu,其配体有NH3和CO。
本题难度:一般
3、选择题 aA、bB、cC、dD、eE五种短周期元素,它们的原子序数有如下关系:c-b=b-a=1且b+c=d,常见化合物E来源:91考试 网2C2与水反应生成C的单质,且溶液使酚酞试液变红.B的最高价氧化物对应水化物为强酸.下列说法正确的是( )
A.B与D形成的单质分别为甲、乙,非金属性:B>D,活泼性:乙>甲
B.1molE2C2与足量水完全反应生成C的单质,共转移电子2mol
C.原子半径:D>E>A>B>C
D.C的氢化物的沸点低于B的氢化物的沸点
参考答案:aA、bB、cC、dD、eE五种短周期元素,常见化合物E2C2与水反应生成C的单质,且溶液使酚酞试液变红,为过氧化钠与水反应生成氢氧化钠与氧气,故E为Na元素,C为O元素,原子序数:c-b=b-a=1,B的原子序数为7,A的原子序数为6,故B为N元素,A为C元素,由于b+c=d,D的原子序数为7+8=15,故D为P元素,
A、同主族自上而下非金属性减弱,故非金属性N>P,氮气的分子中为N≡N三键,键能很大,化学性质活泼,故活泼性乙>甲,故A正确;
B、1molNa2O2与足量水完全反应生成O2,反应中过氧化钠是氧化剂又是还原剂,各占一半,起还原剂作用的过氧化钠,氧元素化合价由-1价升高为0价,故转移电子为1mol,故B错误;
C、同周期自左而右,原子半径减小,同主族自上而下原子半径增大,故原子半径Na>P>C>N>O,即E>D>A>B>C,故C错误;
D、水常温下为液体,氨气常温下为气体,故水的沸点更高,故D错误;
故选A.
本题解析:
本题难度:一般
4、选择题 氮的单质有N2、N4(标准状况下是气体)、N30等,NA表示阿伏加德罗常数。下列说法正确的是
A.N2、N4、N30是同分异构体
B.相同质量的N2、N4、N30含有的分子数相同
C.N2、N4、N30分子中的化学键只有共价键
D.2.24L N2和1.12L N4中所含有的氮原子数都是0.2NA
参考答案:C
本题解析:分子式相同,结构不同的化合物是同分异构体,A不正确,应该是同素异形体;B中单质的摩尔质量不同,所以物质的量的不同,则分子数不同;D中状态不一定是标准状况下,不正确;氮元素是非金属元素,氮和氮之间形成的化学键是非极性键,C正确,答案选C。
本题难度:一般
5、填空题 配位键是一种特殊的共价键,即共用电子对由某原子单方面提供和另一缺电子的粒子结合。如NH4+就是由NH3(氮原子提供电子对)和H+(缺电子)通过配位键形成的。据此,回答下列问题:
(1)下列粒子中可能存在配位键的是________。
A.CO2
B.H3O+
C.CH4
D.H2SO4
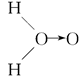 、乙:H—O—O—H,式中O→O表示配位键,在化学反应中O→O键遇到还原剂时易断裂。化学家Baeyer和Villiyer为研究H2O2的结构,设计并完成了下列实验:a.将C2H5OH与浓H2SO4反应生成(C2H5)2SO4和水;b.将制得的(C2H5)2SO4与H2O2反应,只生成A和H2SO4;c.将生成的A与H2反应(已知该反应中H2做还原剂)。
、乙:H—O—O—H,式中O→O表示配位键,在化学反应中O→O键遇到还原剂时易断裂。化学家Baeyer和Villiyer为研究H2O2的结构,设计并完成了下列实验:a.将C2H5OH与浓H2SO4反应生成(C2H5)2SO4和水;b.将制得的(C2H5)2SO4与H2O2反应,只生成A和H2SO4;c.将生成的A与H2反应(已知该反应中H2做还原剂)。