|
高考化学知识点整理《化学基本概念》高频考点巩固(2019年模拟版)(二)
2019-06-25 21:39:46
【 大 中 小】
|
1、选择题 在2A+B?3C+4D反应中,下面表示的化学反应速率最快的是
A.v(A) = 0.5mol/(L·min)
B.v(B) = 0.05mol/(L·min)
C.v(C) = 0.9mol/(L·min)
D.v(D) = 1.0mol/(L·min)
参考答案:C
本题解析:试题分析:反应速率的比等于化学计量数的比。按照这个说法转化下来,应选C。
考点:化学反应速率。
本题难度:一般
2、选择题 汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3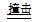 K2O+5Na2O+16N2↑,有关该反应说法正确的是 K2O+5Na2O+16N2↑,有关该反应说法正确的是
A.属于复分解反应
B.KNO3发生氧化反应
C.NaN3是还原剂
D.NaN3和KNO3中氮元素化合价均降低
|
参考答案:C
本题解析:A.该反应有元素化合价的变化,属于氧化还原反应,错误;B. KNO3中氮元素由+5价得电子生成氮气,发生还原反应,错误;C. NaN3中氮元素化合价由-1/3价失电子生成氮气,是还原剂,正确;D. KNO3中氮元素由+5价降低到0价,NaN3中氮元素化合价由-1/3价升高到0价,错误;选C。
考点:考查氧化还原反应。
本题难度:一般
3、填空题 碲(Te)为ⅥA族元素,是当今高新技术新材料的主要成分之一。工业上可从电解精炼铜的阳极泥中提取碲。
(1)粗铜中含有Cu和少量Zn、Ag、Au、TeO2及其他化合物,电解精炼后,阳极泥中主要含有TeO2、少量金属单质及其他化合物。电解精炼粗铜时,阳极电极反应式为 。
(2)TeO2是两性氧化物,微溶于水,可溶于强酸或强碱。从上述阳极泥中提取碲的一种工艺流程如下:
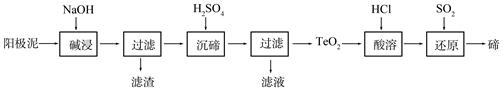
①“碱浸”时TeO2发生反应的化学方程式为 。
②“沉碲”时控制溶液的pH为4.5-5.0,生成TeO2沉淀。如果H2SO4过量,溶液酸度过大,将导致碲的沉淀不完全,原因是 ;防止局部酸度过大的操作方法是 。
③“酸溶”后,将SO2通入TeCl4溶液中进行“还原”得到碲,该反应的化学方程式是 。
参考答案:(1)Zn-2e-=Zn2+ Cu-2e-=Cu2+ (共4分,各2分)
(2)① TeO2+2NaOH=Na2TeO3+H2O (3分)
②TeO2是两性氧化物,H2SO4过量会导致TeO2继续与H2SO4反应导致损失。(3分)
缓慢加入H2SO4,并不断搅拌 (3分)
③ TeCl4 + 2SO2 + 4H2O="Te" + 4HCl + 2H2SO4 (3分)
本题解析:(1)电解精炼粗铜时,粗铜中的Cu和少量Zn在阳极发生氧化反应,Zn比Cu活泼,先失电子,所以阳极电极反应式为Zn-2e-=Zn2+ Cu-2e-=Cu2+
(2)①TeO2是两性氧化物,与氢氧化钠发生类似氧化铝与氢氧化钠的反应,化学方程式为TeO2+2NaOH=Na2TeO3+H2O;
②因为TeO2是两性氧化物,H2SO4过量会导致TeO2继续与H2SO4反应导致损失。防止局部酸度过大的操作方法是缓慢加入H2SO4,并不断搅拌;
③SO2还原TeCl4为Te,本身被氧化为硫酸,化学方程式为TeCl4+2SO2+4H2O=Te+4HCl+2H2SO4
考点:考查粗铜精炼的电解反应式的书写,对给定条件的化学方程式的判断及书写,实验操作的判断
本题难度:困难
4、选择题 下列物质能发生银镜反应的是
A.酒精
B.葡萄糖
C.淀粉
D.纤维素
参考答案:B
本题解析:试题分析:能发生银镜反应的物质含有醛基。酒精中的官能团是羟基,不能发生银镜反应,淀粉和纤维素都是非还原性糖,都不能发生银镜反应。
考点:官能团的性质
点评:掌握官能团的性质。
本题难度:一般
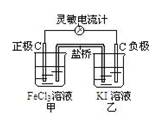
5、填空题 请将氧化还原反应:2Fe3++2I- 2Fe2++I2设计成带盐桥原电池。 2Fe2++I2设计成带盐桥原电池。
试剂:FeCl3溶液,KI溶液;其它用品任选。
请回答下列问题。
(1)请画出设计的原电池装置图,并标出电极材料,电极名称及电解质溶液。
(2)发生还原反应的电极为电池的 极,其电极反应式为 。
(3)反应达到平衡时,外电路导线中 (填“有”或“无”)电流通过。
(4)平衡后向FeCl3溶液中加入少量FeCl2固体,当固体全部溶解后,则此溶液中电极变为 (填“正”或“负”)极。
(5)请设计简单实验,证明溶液中同时存在Fe3+、Fe2+ 。
参考答案:(1)
(2)正(2分),Fe3++e-=Fe2+(2分)
(3)无(2分) (4)负(2分)
(5)取少量待检液于试管中,加入硫氰化钾,显红色,说明有Fe3+、;(2分)另取少量待检液于试管中,加入酸性高锰酸钾溶液,若溶液退色,则有Fe2+。(其它合理答案也给分)(2分)
本题解析:略
本题难度:一般
|