1、选择题 A、B是元素周期表中同周期相邻主族的元素,A、B的原子序数依次为a、b且a<b,则a、b之间不可能存在的等式关系是( )
A.b=a+1
B.b=a+11
C.b=a+18
D.b=a+25
参考答案:C
本题解析:
本题难度:一般
2、选择题 A、B、C和D都是周期表中前20号元素,已知A的阳离子和C的阴离子具有相同的核外电子排布,且能形成组成为AC的化合物;C和D属同族元素,其中C中核外电子数是D中核内质子数的2倍.B和D同周期且B的同素异形体之一是原子晶体.下列说法中正确的是( )
A.D元素处于元素周期表中第2周期第Ⅵ族
B.AD2中可能既有离子键又有共价键
C.四种元素的原子半径A>C>D>B
D.BCD分子一定是直线型非极性分子
参考答案:AB
本题解析:
本题难度:一般
3、选择题 下列原子构成的单质中既能与稀硫酸反应,又能与烧碱溶液反应,且都产生H2的是
[? ]
A.核内无中子的原子
B.外围电子排布为3s23p1
C.最外层电子数等于倒数第三层上的电子数的原子
D.N层上无电子,最外层上的电子数等于电子层数的原子
参考答案:BD
本题解析:
本题难度:一般
4、选择题 短周期元素X、Y、Z和W的原子序数依次递增,且在同一周期,四种元素原子的最外层电子数之和为19,X和Y元素原子的原子序数比为6:7,X的最高正价是W的最低负价的绝对值的2倍.下列说法正确的是( )
A.X单质可以通过铝热法获得
B.Y的氧化物是良好的半导体材料
C.Z的氢化物比W的氢化物更稳定
D.X的最高价氧化物和Z的最高价氧化物化合的产物中有共价键和离子键
参考答案:短周期元素X、Y、Z和W的原子序数依次递增,且在同一周期,X和Y元素原子的原子序数比为6:7,如果X的原子序数为6,则X、Y、Z和W的最外层电子数只能为4、5、6、7,四种元素原子的最外层电子数之和为22,而且X的最高正价是W的最低负价的绝对值的4倍,不符合题意;
如果X的原子序数为12,X和Y元素原子的原子序数比为6:7,Y的原子序数应为14,由于X的最高正价是W的最低负价的绝对值的2倍,则W的原子序数为17,四种元素原子的最外层电子数之和为19,Z只能是16号元素,所以X、Y、Z和W以此为Mg、Si、S、Cl元素,
A、X为Mg元素,比Al活泼,不能用铝热法制取,故A错误;
B、硅单质是良好的半导体材料,二氧化硅不是,故B错误;
C、同周期元素从左到右元素的非金属性逐渐增强,元素对应的氢化物的稳定性逐渐增强,则氯化氢的稳定性大于硫化氢,故C错误;
D、X的最高价氧化物和Z的最高价氧化物化合的产物为硫酸镁,属于含氧酸盐,既含有离子键,又含有共价键,故D正确.
故选D.
本题解析:
本题难度:简单
5、填空题 A、B、C三种元素的原子具有相同的电子层数,而B的核电荷数比A大1,C原子的电子总数比B原子的电子总数多4;?1molA的单质能跟足量的盐酸反应,在标准状况下可置换出22.4L的H2,这时A转变为与氖原子具有相同电子层结构的离子.试回答:
(1)写出A和C组成的化合物的电子式______;
(2)B的离子结构示意图是______,与B的离子具有相同电子数的分子中,有一种分子可与盐酸化合生成一种盐,该盐的电子式是______;
(3)写出C元素的单质和甲烷发生一元取代反应的化学方程式______;
(4)写出A最高价氧化物的水化物和C最高价氧化物的水化物之间反应的离子方程式:______.
参考答案:A、B、C三种元素的原子具有相同的电子层数,1molA的单质能跟足量的盐酸反应,在标准状况下可置换出22.4L的H2,A为金属,令A反应后化合价为x,则根据电子转移守恒,1x=2,所以x=2,即A反应后为+2价,这时A转变为与氖原子具有相同电子层结构的离子,则A为镁元素.而B的核电荷数比A大1,则B为铝元素;C原子的电子总数比B原子的电子总数多4,则C为氯元素.
(1)A为镁元素,C为氯元素,二者形成氯化镁,是离子化合物,有镁离子与氯原子构成,电子式为
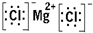
.
故答案为:
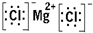
.
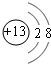
(2)B的离子是铝离子,质子数为13,核外电子数为10,有2个电子层,最外层有8个电子,结构示意图是
;与铝离子具有相同电子数的分子中,有一种分子可与盐酸化合生成一种盐,该盐是氯化铵,氯化铵是离子化合物有铵根离子与氯离子构成,电子式是
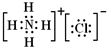
.
故答案为:

;
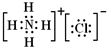
.
(3)氯气和甲烷发生一元取代反应生成一氯甲烷和氯化氢,反应化学方程式CH4+Cl2光照
本题解析:
本题难度:一般