1、选择题 在0.1 mo l · L-1的NH3·H2O溶液中,下列关系式正确的是(?).
A c(NH3·H2O)>c(OH-)>c(NH4+)>c(H+)
B c(NH4+)>c(NH3·H2O)>c(OH-)>c(H+)
C c(NH3·H2O)>c(NH4+)=c(OH-)>c(H+)?
D c(NH3·H2O)>c(NH4+)>c(H+)>c(OH-)
2、选择题 在100ml下列溶液中,分别加入0.05molNaOH固体,溶液的导电性变化不大的是
A.蒸馏水
B.0.5mol/L的CH3COOH
C.0.5mol/L的HCl
D.0.5mol/L的氨水
3、选择题 用水稀释0.1摩/升氨水时,溶液中随着水量的增加而减小的是
A.
B.
C.[H+]和[OH-]的乘积
D.OH-的物质的量
4、填空题 对于弱酸在-定温度下达到电离平衡时,各粒子的浓度存在一种定量的关系.若在25℃时有HA?H++A-,则K=c(H+)?c(A-)/c(HA),式中K为电离平衡常数,只与温度有关,各粒子的浓度为达到平衡时的浓度.下表是几种常见弱酸的电离平衡常数(25℃)
| 酸 | 点解方程式 | 电离平衡常数
CH3COOH
CH3COOH?CH3COO-+H+
K=1.76×10-5
H2CO3
H2CO3?HCO3-+H+
HCO3-?CO32-+H+
K1=4.31×10-7
K2=5.61×10-11
H2S
H2S?HS-+H+
HS-?S2-+H+
K1=9.1×10-8
K2=1.1×10-15
H3PO4
H3PO4?H2PO4-+H+
H2PO4-?HPO42-+H+
HPO42-?PO43-+H+
K1=7.52×10-3
K2=6.23×10-8
K3=2.20×10-13
|
回答下列问题:
(1)K只与温度有关,当温度升高时,K值______(填“增大”、“减小”或“不变”)
(2)在温度相同时,各弱酸K值不同,那么K值的大小与酸性相对强弱的关系是:______.
(3)若把CH3COOH、H2CO3、HCO3-、H2S、HS-、H3PO4、H2PO4-、HPO42-都看作是酸,其中酸性最强的是______,最弱的是______.
(4)电离平衡常数是用实验的方法测定出来的,现已经测得25℃时cmol/L的CH3COOH的电离度为α(当若电解质在溶液里达到电离平衡时,溶液中已电离的电解质分子占原来总分子数的百分数叫做该电解质的电离度).试表示该温度下醋酸的电离平衡常数K=______.
5、选择题 室温下,将1.00mol ? L-1盐酸滴人20. OO mL?1.OOmol ? L-1的氨水中,溶液pH和温度随加入盐酸体积的变化曲线如下图所示。
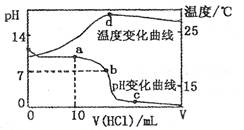
下列有关说法中不正确的是
A.a点溶液中离子浓度大小的关系: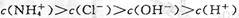
B.b点溶液中离子浓度大小的关系: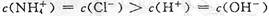
C.c点溶液中离子浓度大小的关系: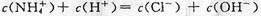
D.d点时溶液温度达到最高,之后温度略有下降,原因是NH3? H2O电离吸热