1、填空题 一定温度下2L的恒容容器甲中,加入2moL碳和2moLCO2发生如下反应: C(s)+CO2(g)  2CO(g) △H>0
2CO(g) △H>0
测得容器中CO2的物质的量随时间t的变化关系如图所示。
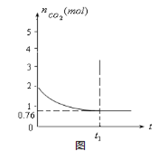
(1)该反应的ΔS 0(填“>”、“<”或“=”)。在 (填“较高”或“较低”)?温度下有利于该反应自发进行。
(2)列式并计算上述温度下此反应的平衡常数K 。(结果保留一位小数)
(3)向上述平衡体系中再通入CO2,则CO2的转化率 (填增大、减小、不变、无法确定)。
(4)相同温度下,2L的恒容容器丙中加入4moL碳、4moLCO2和4moLCO。开始反应时v(正) v(逆)(填>、 <、﹦)。
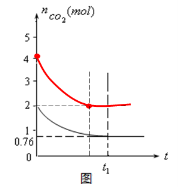
(5)相同温度下,2L的恒容容器乙中加入4moL碳和4moLCO2,达到平衡。请在图中画出乙容器中CO2的物质的量随时间t变化关系的预期结果示意图。(注明平衡时CO2的物质的量)
参考答案:(1)> 较高(2分,各1分)
(2)K=c2(CO)/c(CO2)=1.242/0.38="4.0" (3分)
(3)减少(2分)
(4) >(2分)
(5)如图 (3分)
本题解析:(1)生成物中气体的化学计量数之和大于反应物中气体的化学计量数之和;该反应为吸热反应;
(2)平衡常数是指可逆化学反应达到平衡时,每个产物浓度系数次幂的连乘积与每个反应物浓度系数次幂的连乘积之比;
(3)通入二氧化碳使其浓度增大,平衡向右移动,但其的转化率降低;
(4)因为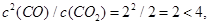 所以平衡向右移动,正反应速率大于逆反应速率;
所以平衡向右移动,正反应速率大于逆反应速率;
(5)因为 的浓度增大,所以反应速率加快,达到平衡的时间减少,设消耗Xmol
的浓度增大,所以反应速率加快,达到平衡的时间减少,设消耗Xmol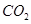 ,则有
,则有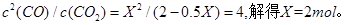
本题难度:困难
2、选择题 在一密闭容器中,mA(g)+bB(g)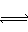 pC(g)反应平衡时,测得c(A)为0.5 mol·L-1,在温度不变的情况下,将容器体积增大一倍,当达到新的平衡时,测得c(A)为0.3 mol·L-1,则下列判断中正确的是
pC(g)反应平衡时,测得c(A)为0.5 mol·L-1,在温度不变的情况下,将容器体积增大一倍,当达到新的平衡时,测得c(A)为0.3 mol·L-1,则下列判断中正确的是
A.平衡向正反应方向移动了? B.物质B的转化率减小了
C.化学计量数:m+n<p?D.物质C的质量分数增加了
参考答案:B
本题解析:将容器体积增大一倍的瞬间,A的浓度应该是0.25mol/L,但最终平衡时,测得c(A)为0.3 mol·L-1,这说明降低压强,平衡向生成A的方向移动,即向逆反应方向移动,所以正反应是体积减小的可逆反应,所以选项B正确,答案选B。
点评:该题是高考中的常见题型,主要是考查学生对勒夏特例原理的了解掌握程度。该题的关键是弄清楚增大体积的瞬间物质的浓度和最终平衡时物质的浓度的对比,这样才能得出正确的结论。
本题难度:一般
3、选择题 一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生NO2(g)+SO2(g)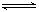 SO3(g)+NO(g)的可逆反应,下列能说明反应达到平衡状态的是(?)
SO3(g)+NO(g)的可逆反应,下列能说明反应达到平衡状态的是(?)
A.体系压强保持不变
B.混合气体颜色保持不变
C.SO3和NO的体积比保持不变
D.每消耗1 mol SO3的同时生成1 mol NO2
参考答案:B
本题解析:A错,该反应为等体积反应,无论平衡与否体系压强均不变;B正确;C错,不一定,平衡时体系内各组分的浓度保持不变;D错,每时每刻都是这样反应;
本题难度:简单
4、选择题 在恒温、恒容下,当反应容器内总压强不随时间变化时,下列可逆反应一定达到平衡的是( )
A.A(g)+B(g) C(g)
C(g)
B.A(g)+2B(g) 3C(g)
3C(g)
C.A(g)+B(g) C(g)+D(g)
C(g)+D(g)
D.以上都达到平衡
参考答案:A
本题解析:A中反应前后气体物质的量不等,恒温恒容下总压强不变,反应达平衡;B、C反应前后气体物质的量相等,不论是否达到平衡总压强不变。
本题难度:一般
5、选择题 在温度不变的条件下,密闭容器中发生如下反应:2SO2+O2 2SO3,下列叙述能够说明反应已经达到平衡状态的是(?)
2SO3,下列叙述能够说明反应已经达到平衡状态的是(?)
A.容器中SO2、O2、SO3共存
B.SO2与SO3的浓度相等
C.容器中SO2、O2、SO3的物质的量之比为2∶1∶2
D.反应容器中压强不随时间变化
参考答案:D
本题解析:在一定条件下,当可逆反应中正反应速率和逆反应速率相等时(但不为0),各种物质的浓度或含量均不再发生变化的状态,是化学平衡状态。平衡时浓度不再发生变化,但物质之间的浓度不一定相等或满足某种关系,因此选项B、C都是错误的。选项A也不正确,因为只要是可逆反应,反应物和生成物一定同时存在;根据方程式可知,反应是体积减小的,所以压强也是减小的,因此当压强不再发生变化时,可以说明反应达到平衡状态,答案选D。
本题难度:简单