1、选择题 某可逆反应正向反应过程中能量变化如图所示,下列说法正确的是(? )

A.该反应为吸热反应
B.当反应达到平衡时,降低温度,A的转化率减小
C.升高温度平衡常数K增大;压强增大,平衡向正反应方向移动
D.加入催化剂,反应速率增大,E1减小,E2减小,反应热不变
参考答案:D
本题解析:由图中的信息可知反应后能量降低,故为放热反应,降低温度,平衡向正反应方向移动,A的转化率提高,升高温度,平衡向逆反应方向移动,K减小,故A、B、C错误;加入催化剂,可以降低反应的活化能,但不改变反应热,故D正确。
本题难度:一般
2、选择题 一定条件下,在体积为10L的密闭容器中,1mol X和1mol Y进行反应:2X(g)+Y(g)?Z(g),经60s达到平衡,生成0.3mol Z,下列说法正确的是( )
A.以X浓度变化表示的反应速率为0.001mol/(L?s)
B.将容器体积变为20L,Z的平衡浓度变为原来的
C.若升高温度Y的转化率减小,则正反应为吸热反应
D.达到平衡时,X与Y?的浓度相等
参考答案:2X(g)+Y(g)?Z(g),
开始1mol?1mol? 0
转化0.6mol?0.3mol? 0.3mol
平衡0.4mol?0.7mol? 0.3mol
A.以X浓度变化表示的反应速率为0.6mol10L60s=0.001mol/(L?s),故A正确;
B.将容器体积变为20L,压强减小,平衡逆向移动,则Z的平衡浓度小于原来的12,故B错误;
C.若升高温度Y的转化率减小,则升高温度,平衡逆向移动,故C错误;
D.达到平衡时,X的浓度为0.04mol/L,Y的浓度为0.07mol/L,二者不相等,故D错误;
故选A.
本题解析:
本题难度:一般
3、计算题 一定温度下,在密闭容器中,发生反应: 2NO2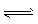 2NO+O2,经过一定时间后,测得混合气中NO2浓度为0.06 mol·L-1, O2的浓度为0.12 mol·L-1,且各物质的浓度不再发生变化。
2NO+O2,经过一定时间后,测得混合气中NO2浓度为0.06 mol·L-1, O2的浓度为0.12 mol·L-1,且各物质的浓度不再发生变化。
求:
(1)NO2的起始浓度? ;
(2)此时NO2的转化率? 。
参考答案:(1)0.3 mol/L
(2)80%
本题解析:
本题难度:一般
4、计算题 将相同物质的量的SO3充入下面的两个容器中,已知甲容器有活塞可以上下移动,乙容器体积固定,在相同的温度、压强下开始发生反应:2SO3(g) ?2SO2(g)+O2(g),在反应过程中维持体系温度不变。
?2SO2(g)+O2(g),在反应过程中维持体系温度不变。
(1)求达到平衡状态时SO3气体的转化率的大小关系?
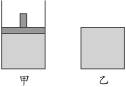 图2-2
图2-2
(2)达到平衡状态时分别充入一定量的Ar气,平衡是否会移动?会怎样移动?
参考答案:(1)甲容器中SO3的转化率比乙容器中SO3的转化率要大
(2)甲容器平衡向正反应方向移动,SO3的转化率增大,乙容器平衡不移动
本题解析:开始时两个容器中SO3的物质的量、体积、温度都是相等的,而且在反应过程中维持温度不变,即两个容器的温度始终是相同的,由于反应是一个气体分子数目增多的反应,所以对于乙容器来说,随着反应的不断进行其压强会逐渐增大,而甲容器随着气体分子数目的增多,活塞会逐渐向上移动,其体积会逐渐增大,所以乙容器相当于在A容器的基础上进行加压,而对于可逆反应2SO3(g) ?2SO2(g)+O2(g),加压会使得平衡向逆反应方向移动,这样会使转化率减小,所以达到平衡状态时甲容器中SO3的转化率比乙容器中SO3的转化率要大。
?2SO2(g)+O2(g),加压会使得平衡向逆反应方向移动,这样会使转化率减小,所以达到平衡状态时甲容器中SO3的转化率比乙容器中SO3的转化率要大。
当两个容器中都达到平衡状态后,再分别充入一定量的Ar气,乙容器由于体积没有改变,反应体系中各种物质的浓度并没有变化,正、逆反应速率仍然相等,所以其平衡不会移动。甲容器由于活塞的移动会导致体积增大,三种物质的浓度同等倍数减小,这和直接将活塞向上提一样,所以这时的情况相当于压强减小,其平衡向正反应(气体分子数目增多)方向移动,SO3的转化率要增大。
本题难度:简单
5、选择题 在一密闭容器内发生氨分解反应:2NH3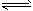 N2+3H2。已知NH3起始浓度是2.6 mol·L-1,4s末为1.0
N2+3H2。已知NH3起始浓度是2.6 mol·L-1,4s末为1.0
mol·L-1,若用NH3的浓度变化来表示此反应的速率,则v(NH3)应为
[? ]
A.0.04 mol·L-1·s-1
B.0.4 mol·L-1 ·s-1
C.1.6 mol·L-1·s-1
D.0.8 mol·L-1·s-1
参考答案:B
本题解析:
本题难度:简单