|
高考化学知识点整理《离子共存》试题特训(2019年最新版)(二)
2019-06-25 21:46:38
【 大 中 小】
|
1、选择题 在水溶液中能大量共存的一组离子是
A.NH4+、Na+、NO3-、SO42-
B.H+、Fe2+、SO42-、NO3-
C.H+、Mg2+、SiO32-、SO42-
D.H+、Al3+、ClO-、Cl-
|
参考答案:A
本题解析:NH4+、Na+、NO3-、SO42-各离子能大量共存,A项正确;H+与Fe2+与NO3-反应不能大量共存,B项错误;H+与SiO32-反应不能大量共存,C项错误;H+与ClO-反应不能大量共存,D项错误;选A。
考点:考查离子共存。
本题难度:一般
2、选择题 室温下,下列各组离子能大量共存的是
A.稀硫酸中:K+、Mg2+、AlO2-、S2O32-
B.NaHS溶液中:SO42-、K+、Cl-、Cu2+
C. =10-13mol/L溶液中:Fe3+、NH4+、Mg2+、 SO42- =10-13mol/L溶液中:Fe3+、NH4+、Mg2+、 SO42-
D.通入大量CO2的溶液中:Na+、ClO-、CH3COO-、HCO3-
参考答案:C
本题解析:A.在酸性环境中发生反应:4H++AlO2- =Al3++2H2O;2H++S2O32-= H2S2O3↓.不能大量共存。错误 。B.会发生反应:HS-+Cu2+=CuS↓+H+。C。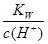 =10-13, =10-13, 所以c(H+)=0.1mol/L.溶液显酸性。在酸性溶液中Fe3+、NH4+、Mg2+、 SO42-不会发生任何反应,可以大量共存,正确。D.因为酸性H2CO3>HClO,通入大量CO2的溶液会发生反应:H2O+CO2+ClO-=HClO+HCO3-.离子不能大量共存。错误。 所以c(H+)=0.1mol/L.溶液显酸性。在酸性溶液中Fe3+、NH4+、Mg2+、 SO42-不会发生任何反应,可以大量共存,正确。D.因为酸性H2CO3>HClO,通入大量CO2的溶液会发生反应:H2O+CO2+ClO-=HClO+HCO3-.离子不能大量共存。错误。
本题难度:一般
3、选择题 将已污染的空气通入某溶液,测其导电性的变化,能获得某种污染气体的含量。如把含H2S的空气通入CuSO4溶液,导电性稍有变化但溶液吸收H2S的容量大;若用溴水,则吸收容量不大而导电性变化大。现要测量空气中的含氯量,并兼顾容量和导电性变化的灵敏度,最理想的吸收溶液是:
A.NaOH溶液
B.蒸馏水
C.Na2SO3溶液
D.KI溶液
参考答案:C
本题解析:
【错解分析】本题错解之一是由于思维定势,对液体吸收气体容量大简单地理解为溶解度较大。常温下氯气在水中的溶解度为1∶2,属于可溶范围,符合吸收容量大的条件;再考虑氯气溶于水生成盐酸和次氯酸的导电性比蒸馏水大大增强,灵敏度也好。因此,选择了B选项。实际上气体的溶解度表示的是在1L水中溶解的气体体积数,而相同物质的量的气体和液体、固体在体积上相差一千倍左右,如:1mol任何气体在标况下的体积为22.4L;1mol水18mL。若1L溶液中含有1mol溶质,它吸收1mol的气体(22.4L),比溶解的气体多得多,何况溶质的物质的量要大,吸收的容量将更大。
错解之二是知识欠缺,只知道氯气能和NaOH溶液反应,生成氯化钠和次氯酸钠,生成物的种类增多,导电的离子浓度增大。因此,兼顾容量和导电性变化的灵敏度。实际上氯气和氢氧化钠的反应如下:
Cl2+2NaOH==NaCl+NaClO+H2O
2molNaOH反应,生成1mol氯化钠和1mol次氯酸钠,离子浓度没有改变,导电的灵敏度不变。
【正解】由于氯气和亚硫酸钠发生如下反应:
Cl2+Na2SO3+H2O==2HCl+Na2SO4
从吸收容量上看:用亚硫酸钠溶质吸收氯气符合题意容量大的要求;从反应方程式上看:1mol亚硫酸钠转化为1mol硫酸钠和2mol盐酸,离子的浓度增大1倍(从离子所带电量总量看),符合导电的灵敏度增大,导电性增强。选项C为正确答案。
本题难度:简单
4、选择题 下列电解质溶液的有关叙述正确的是?
A.在含有AgCl沉淀的溶液中加入NaCl固体,c(Ag+)增大
B.在NH4Cl溶液中加入适量盐酸,可使c(NH4+)=c(Cl-)
C.含l mol KOH的溶液与l mol CO2完全反应后,溶液中c(K+)>c(HCO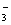 )>c(OH-)>c(H+)>c(CO32-) )>c(OH-)>c(H+)>c(CO32-)
D.同浓度、同体积的强酸与强碱溶液混合后,溶液的pH=7
参考答案:C
本题解析:在含有AgCl沉淀的溶液中加入NaCl固体,抑制溶解,c(Ag+)降低,A错误;在NH4Cl溶液是显酸性的,则其中加入适量盐酸后,不可能使c(NH4+)=c(Cl-),B不正确;C正恰好生成碳酸氢钾,水解程度大于电离程度,溶液显碱性,C正确;D不正确,例如同浓度、同体积的盐酸与氢氧化钡溶液混合后,溶液的pH>7,答案选C。
点评:该题是高考中的常见考点和题型,属于中等难度试题的考查,试题综合性强,在对学生基础知识巩固和训练的同时,侧重对学生能力的培养和解题方法的指导与相连,旨在考查学生灵活运用基础知识决实际问题的能力。该题的关键是明确外界条件是如何影响盐类水解、电离平衡以及溶解平衡的,然后具体问题、具体分析即可,有利于提高学生的逻辑推理能力和应试能力。
本题难度:一般
5、选择题 下列条件下的溶液中,离子一定能大量共存的是( )
A.酸性条件下:Na+、Fe2+、Cl-、NO3-
B.碱性条件下:K+、NH4+、SO42-、NO3-
C.无色酸性条件下:NH4+、Mg2+、MnO4-、SO42-
D.含Ca2+的溶液中:K+、NH4+、Cl-、CH3COO-
参考答案:A、酸性条件下,Fe2+、NO3-离子之间发生氧化还原反应,则不能共存,故A错误;
B、碱性条件下,NH4+、OH-离子之间结合生成弱电解质,则不能共存,故B错误;
C、因MnO4-离子在溶液中为紫色,与无色溶液不符,故C错误;
D、因离子之间不反应,则能大量共存,故D正确;
故选D.
本题解析:
本题难度:简单
|