1、填空题 已知3.01×1023个X气体分子的质量为16g,则X气体的摩尔质量是
参考答案:32g /mol
本题解析:3.01×1023个X气体分子的物质的量为 ,其质量为16g则X气体的摩尔质量
,其质量为16g则X气体的摩尔质量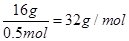
考点:摩尔质量的计算
点评:考查摩尔质量的计算,属于基础题,解题时要抓住物质的量及其推导化式,准确计算。
本题难度:一般
2、选择题 NA表示阿伏加德罗常数,下列叙述中正确的是
A.标准状况下2.24 L三氯甲烷含有分子数目为0.1 NA
B.1mol18O2、16O3混合气体中定含有40NA个质子
C.常温下,100 mL 1 mol·L—1的Na2CO3溶液中的阴离子数目大于0.1NA
D.3.2 g硫与铜充分反应,电子转移总数为0.1NA
参考答案:C
本题解析:A、标准状况下,三氯甲烷是液态,不能适用于气体摩尔体积,A不正确;B、氧气与臭氧都是氧元素形成的不同单质,由于1mol18?O2、16O3混合气体中二者的体积之比不能确定,因此不能确定质子数,B不正确;C、碳酸钠溶于水水解,方程式是CO32-+H2O HCO3-+OH-,即水解过程是阴离子增加的,所以常温下,100 mL 1 mol·L—1的Na2CO3溶液中的阴离子数目大于0.1NA,C正确;D、铜和S反应生成Cu2S,所以3.2 g硫与铜充分反应,转移电子的物质的量是
HCO3-+OH-,即水解过程是阴离子增加的,所以常温下,100 mL 1 mol·L—1的Na2CO3溶液中的阴离子数目大于0.1NA,C正确;D、铜和S反应生成Cu2S,所以3.2 g硫与铜充分反应,转移电子的物质的量是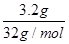 ×2=0.2mol,因此个数为0.2NA,D不正确,答案选C。
×2=0.2mol,因此个数为0.2NA,D不正确,答案选C。
本题难度:一般
3、计算题 有一块表面被氧化成氧化钠的金属钠,质量是10.8g,将它投入到100g水中完全反应后,收集到0.2g氢气,得到密度为1.106g/cm3的溶液,试计算(要求写过程):?
(1)10.8g固体中,金属钠的质量是多少克?
(2)反应后所得溶液中溶质的物质的量浓度为多少?
参考答案:(1)4.6g?(2)4mol/L
本题解析:(1)设金属钠的质量为m,根据反应的化学方程式计算,
2Na+2H2O═2NaOH+H2↑
2×23g? 2g
m? 0.2g
m=4.6g
答:未被氧的金属钠为4.6g;
(2)n(Na)=0.2mol,固体中m(Na20)=10.8g-4.6g=6.2g? n(Na20)=0.1mol由反应2Na+2H2O═2NaOH+H2↑,Na2O+H2O═2NaOH可知溶液中溶质的物质的量为:n(NaOH)=0.2mol+2×0.1mol=0.4mol,溶液的质量为:100g+10.8g-0.2g,溶液的体积为:V=m/ρ=100ml,即0.1L,c=n/v=4mol/L.
本题难度:一般
4、选择题 物质的量浓度相同的NaCl、MgCl2、AlCl3种溶液,当它们的体积比为3:2:1时,3种溶液中Cl-的物质的量浓度之比为( )
A.1:1:1
B.1:2:3
C.3:2:1
D.3:4:3