1、选择题 精确配制250 mL一定物质的量浓度的NaOH溶液,下列实验操作中正确的是(? )
A.选用规格为500 mL的容量瓶
B.将称好的氢氧化钠固体放在容量瓶中,加少量水溶解
C.在烧杯中溶解氢氧化钠后,立即将所得溶液注入容量瓶
D.将烧杯中的氢氧化钠溶液注入未经干燥的干净的容量瓶中
参考答案:D
本题解析:该题主要考查同学们对配制一定物质的量浓度溶液实验原理的理解和实验步骤的掌握,可采用逐项分析法。在配制一定物质的量浓度的溶液时,容量瓶规格的选择应尽可能与所配制溶液的体积相一致,若要求配制的溶液的体积和容量瓶容量恰好相等,就选择该容量瓶;若要求配制的溶液体积和容量瓶容量不相等,应选择容量略大于要求配制的溶液体积的容量瓶。例如,配制480 mL一定浓度的NaOH溶液,应选择500 mL容量瓶。本题应选用250 mL容量瓶,A选项错;氢氧化钠在溶解过程中放热,直接在容量瓶中溶解或将热溶液倾入其中会造成误差。B、C选项错误。正确的做法是先在一只小烧杯中将氧氧化钠固体用少量水溶解,冷却至室温后再转移至容量瓶中;在配制过程中,只要保证溶质都进入容量瓶,就可以准确配制指定浓度的溶液,而容量瓶只要干净即可,是否有水不受影响,D选项正确。
本题难度:简单
2、选择题 用容量瓶配制一定物质的量浓度的溶液,该容量瓶必须是( )
A.干燥的
B.不漏水的
C.用欲配制的溶液润洗过的
D.以上三项均需要求
参考答案:B
本题解析:
本题难度:一般
3、选择题 多少摩尔CaCl2溶解在1 mol H2O中,才能使Cl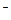 与H2O分子的物质的量之比为1∶10(? )
与H2O分子的物质的量之比为1∶10(? )
A.0.1 mol
B.10 mol
C.0.5 mol
D.0.05 mol
参考答案:D
本题解析:已知n (H2O)="1" mol
n (Cl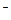 )∶n (H2O)=1∶10
)∶n (H2O)=1∶10
故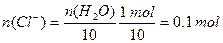
又n (Cl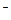 )=2n(CaCl2)
)=2n(CaCl2)
所以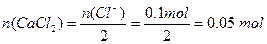
本题难度:简单
4、选择题 设NA为阿伏加德罗常数的值。下列叙述正确的是
A.0.1 mol Cl2全部溶于水后转移电子的数目为0.1NA
B.标准状况下,0.56 L丙烷中含有共价键的数目为0.2NA
C.25℃时,1 L pH=12的Na2CO3溶液中含有Na+的数目为0.02NA
D.常温常压下,14 g C2H4、C3H6的混合气体中含有碳原子的数目为NA
参考答案:D
本题解析:A、氯气与水反应为可逆反应,不能完全反应,故转移电子的数目小于0.1NA,错误;B、0.56 L丙烷中含有共价键的数目为0.56÷22.4×10=0.25mol,错误;C、溶液的碱性是由于水解产生,无法根据溶液的pH计算Na+的数目,错误;D、C2H4、C3H6的最简式为CH2,14 g C2H4、C3H6的混合气体中含有碳原子的数目为14÷14×1=1mol,正确。
本题难度:一般
5、填空题 (8分)(1)从30mL0.5mol·L-1 NaOH溶液中取出10 mL:这10 mL溶液的物质的量浓度是 mol·L-1,其中的溶质质量是 g。
(2)将30mL0.5mol·L-1 NaOH溶液加水稀释到500mL,稀释后溶液中NaOH的物质的量浓度是 mol·L-1。
(3)现有体积相同的NaCl、MgCl2、AlCl3三种溶液,分别加入足量的硝酸银溶液,Cl-沉淀完全时,消耗等物质的量的AgNO3,则三种溶液的物质的量浓度之比为 。
参考答案:(1)0.5, 0.2。 (2)0.03。(3)6:3:2。(每空2分)
本题解析:略
本题难度:一般