1、选择题 设NA表示阿伏加德罗常数,下列有关说法正确的是
A.3.4g NH3中含N—H键数目为0.2 NA
B.标准状况下,2.24 L Cl2与过量稀NaOH溶液反应,转移的电子总数为0.2 NA
C.7.8 g Na2O2含有的阴离子数目为0.2 NA
D.46g NO2和N2O4的混合气体中含有的原子个数为3NA
参考答案:D
本题解析:氨气分子中还原3个N-H键,3.4g氨气是0.2mol,含有0.6molN-H键,A不正确;氯气和氢氧化钠溶液的反应中转移1个电子,所以标准状况下,2.24 L Cl2与过量稀NaOH溶液反应,转移的电子总数为0.1 NA,B不正确;过氧化钠中阴离子和阳离子的个数之比是1︰2的,所以选项C不正确,7.8 g Na2O2含有的阴离子数目为0.1 NA;NO2和N2O4的最简式相同,都是NO2,所以46g NO2和N2O4的混合气体中含有的原子个数为3NA,答案选D。
点评:阿伏加德罗常数是历年高考的“热点”问题。多年来全国高考化学试题重现率几乎为100%。考查阿伏加德罗常数的应用的题目,为高考必考题目,这是由于它既考查了学生对物质的量、粒子数、质量、体积等与阿伏加德罗常数关系的理解,又可以涵盖多角度的化学知识内容。要准确解答好这类题目,一是要掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系;二是要准确弄清分子、原子、原子核内质子中子及核外电子的构成关系。
本题难度:一般
2、选择题 在T℃时,将a g NH3完全溶于水,得到V mL溶液,假设该溶液的密度为ρ g·cm-3,溶质的质量分数为w,其中含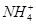 的物质的量为b mol。下列叙述中正确的是( )
的物质的量为b mol。下列叙述中正确的是( )
A.溶质的质量分数为w=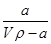 ×100%
×100%
B.上述溶液中再加入V mL水后,所得溶液溶质的质量分数大于0.5w
C.溶液中c(OH-)=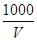 mol·L-1
mol·L-1
D.溶质的物质的量浓度c=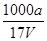 mol·L-1
mol·L-1
参考答案:D
本题解析:溶液的质量是Vρg,所以溶质的质量分数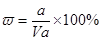 ,A不正确;氨水的密度小于水的,所以上述溶液中再加入V mL水后,所得溶液溶质的质量分数小于0.5w,B不正确;溶液中OH-的物质的量大于bmol,浓度大于
,A不正确;氨水的密度小于水的,所以上述溶液中再加入V mL水后,所得溶液溶质的质量分数小于0.5w,B不正确;溶液中OH-的物质的量大于bmol,浓度大于 ,所以选项C不正确;溶质氨气的物质的量是a/17mol,所以溶液的浓度是c=
,所以选项C不正确;溶质氨气的物质的量是a/17mol,所以溶液的浓度是c=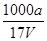 ?mol·L-1,D正确,答案选D。
?mol·L-1,D正确,答案选D。
本题难度:一般
3、选择题 下列实验操作使测定(或配制)结果偏低的是( )
A.测量一包固体的质量,将药品放在右盘,砝码放在左盘
B.中和滴定用的锥形瓶加入少量待测液润洗后,再加待测液
C.在保温容器中测量NaOH和稀盐酸反应的中和热时加入稍过量的NaOH溶液
D.配制一定物质的量浓度的溶液,定容时仰视刻度线
参考答案:D
本题解析:
本题难度:简单
4、填空题 (4分) 在干燥烧瓶中用向上排空气法收集氯化氢,由于空气不可能排净,所以瓶内气体对氢气的相对密度为17,将此瓶气体倒置于水槽中(氯化氢极易溶于水),烧瓶内液面上升的体积占烧瓶总体积的 (填分数) ,假设溶质不向烧瓶外扩散,则所得盐酸中氯化氢的物质的量浓度为 mol/L(假设在标准状况下)
参考答案:液面上升的体积占烧瓶总体积的 2/3 (填分数) ,
物质的量浓度为 1/22.4 mol/L
本题解析:略
本题难度:一般
5、选择题 下列说法正确的是
A.1 L水中溶解了58.5 g NaCl,该溶液的物质的量浓度为1 mol/L
B.从1 L 2 mol/L的H2SO4溶液中取出0.5 L,该溶液的浓度为1 mol/L
C.配制500 mL 0.5 mol/L的CuSO4溶液,需62.5 g胆矾
D.中和100 mL 1 mol/L的H2SO4溶液,需NaOH为4 g
参考答案:C
本题解析:A、H2O的体积是1L,NaCl溶液的体积不是1L,错误;B、从1 L 2 mol/L的H2SO4溶液中取出0.5 L,该溶液的浓度仍然为2 mol?L?1,错误;C、配制500 mL 0.5 mol/L的CuSO4溶液,需胆矾的质量为:0.5L×0.5mol/L×250g/mol=62.5g,正确;D、根据化学方程式:H2SO4+2NaOH=Na2SO4+2H2O可知m(NaOH)=0.1L×1mol/L×2×40g/mol=8g,错误。
本题难度:简单