1、选择题 下列说法中正确的是( )
A.在Na2CO3溶液中滴入酚酞试液,呈红色
B.(NH4)2SO4溶液中c(NH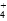 )∶c(SO
)∶c(SO )=2∶1
)=2∶1
C.FeCl3溶于水使溶液呈酸性,从而抑制水的电离
D.将Al2(SO4)3溶液蒸干得到Al(OH)3固体
参考答案:A
本题解析:CO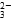 +H2O
+H2O HCO
HCO +OH-,Na2CO3溶液显碱性,滴入酚酞试液,呈红色;因NH
+OH-,Na2CO3溶液显碱性,滴入酚酞试液,呈红色;因NH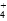 水解,故(NH4)2SO4溶液中c(NH
水解,故(NH4)2SO4溶液中c(NH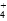 )∶c(SO
)∶c(SO )<2∶1;FeCl3溶于水能促进水的电离;因H2SO4不是挥发性酸,Al2(SO4)3溶液蒸干仍得Al2(SO4)3,不会得到Al(OH)3。
)<2∶1;FeCl3溶于水能促进水的电离;因H2SO4不是挥发性酸,Al2(SO4)3溶液蒸干仍得Al2(SO4)3,不会得到Al(OH)3。
本题难度:一般
2、选择题 FeCl3的水解方程式可写为FeCl3+3H2O  Fe(OH)3+3HCl,若提高水解程度采取的方法是 (? )
Fe(OH)3+3HCl,若提高水解程度采取的方法是 (? )
A.降低温度
B.加入少量Na2CO3
C.加入少量盐酸
D.增加FeCl3的浓度
参考答案:B
本题解析:盐的水解反应是酸碱中和反应的逆反应。由于酸碱中和反应为放热反应,所以盐的水解反应是吸热反应。A.降低温度根据平衡移动原理,平衡会向放热反应方向即向逆反应方向移动,盐的水解程度减小。错误。B.加入少量Na2CO3。由于Na2CO3是强碱弱酸盐,水解使溶液显碱性,此时该盐水解产生的OH-会消耗FeCl3的水解产生的H+,由于减小了生成物的浓度,平衡正向移动,FeCl3的水解程度增大。正确。C.加入少量盐酸,c(H+)增大,由于生成物的浓度增大,平衡逆向移动,FeCl3水解程度减小。错误。D.增加FeCl3的浓度,增大了反应物的浓度,平衡正向移动,但由于平衡移动的趋势是很微弱的,投入量原大于平衡移动消耗量,所以FeCl3的水解程度反而减小。错误。
本题难度:一般
3、选择题
A.c(NH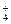 )>c(Cl-)>c(H+)>c(OH-)
)>c(Cl-)>c(H+)>c(OH-)
B.c(NH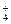 )>c(Cl-)>c(OH-)>c(H+)
)>c(Cl-)>c(OH-)>c(H+)
C.c(Cl-)>c(NH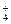 )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
D.c(Cl-)>c(NH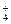 )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
参考答案:B
本题解析:pH=3的盐酸的浓度为10-3 mol·L-1,而pH=11的氨水的浓度大约为0.1 mol·
L-1远大于盐酸的浓度,故等体积混合后氨水过量,混合液中有
NH4Cl===NH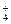 +Cl-?①
+Cl-?①
NH3·H2O(过量的) NH
NH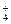 +OH-?②
+OH-?②
①式中c(NH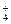 )=c(Cl-)而溶液中c(NH
)=c(Cl-)而溶液中c(NH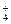 )总是①、②两式电离出的c(NH
)总是①、②两式电离出的c(NH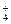 )之和,故c(NH
)之和,故c(NH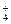 )>c(Cl-),又氨水过量溶液呈碱性故c(OH-)>c(H+),而氨水为弱电解质,故电离的c(OH-)一定小于c(Cl-)。
)>c(Cl-),又氨水过量溶液呈碱性故c(OH-)>c(H+),而氨水为弱电解质,故电离的c(OH-)一定小于c(Cl-)。
本题难度:简单
4、选择题 下列盐既能发生水解反应,蒸干该盐溶液并充分加热后又能得到该盐(加热体系)的是
A.Na2CO3
B.AlCl3
C.NaCl
D.NH4Cl
参考答案:A
本题解析:A、正确;B、加热时水解产生的HCl挥发,平衡正向移动得到氢氧化铝,错误;C、不水解,错误;D、受热易分解,错误。
本题难度:一般
5、选择题 下列混合溶液中,各离子浓度的大小顺序正确的是?(?)
A.10 mL 0.1 mol·L-1氨水与10 mL 0.1 mol·L-1盐酸混合,
c(Cl-)>c(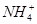 )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
B.10 mL 0.1 mol·L-1NH4Cl溶液与5 mL 0.2 mol·L-1NaOH溶液混合,
c(Na+)=c(Cl-)>c(OH-)>c(H+)
C.10 mL 0.1 mol·L-1CH3COOH溶液与5 mL 0.2 mol·L-1NaOH溶液混合,
c(Na+)=c(CH3COO-)>c(OH-)>c(H+)
D.10 mL 0.5 mol·L-1NaOH溶液与6 mL 1 mol·L-1盐酸混合,