1、选择题
A.c(CO32-)+c(HCO3-)+c(H2CO3)=0.1mol/L
B.2c(CO32-)+c(HCO3-)+c(OH-)=c(Na+)+c(H+)
C.c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)
D.c(CO32-)>c(HCO3-)>c(OH-)>c(H+)
参考答案:D
本题解析:解答关于溶液中例子浓度大小比较,可考虑溶液中电荷守恒、物料守恒、H+守恒,在0.1mol/L Na2CO3溶液中,由于碳酸根离子的水解是分步水解,故c(OH-) > c(HCO3-),D错。
本题难度:一般
2、选择题 pH都为4的盐酸和NH4Cl溶液,向盐酸中加入amL水,向NH4Cl溶液中加入bmL水,结果两溶液的pH仍然相等。则a与b的关系正确的是()
A.a<b
B.a>b
C.a="b"
D.无法确定
参考答案:A
本题解析:盐酸是强电解质,HCl完全电离出H+和Cl-,加水只造成溶液的体积变大,而H+的物质的量不变,NH4Cl在溶液中存在水解平衡: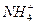 +H2O
+H2O NH3·H2O+H+。加水,使水解平衡右移,在体积增大的同时,H+的物质的量也增多,故应加入更多的水才能与盐酸的pH相同。
NH3·H2O+H+。加水,使水解平衡右移,在体积增大的同时,H+的物质的量也增多,故应加入更多的水才能与盐酸的pH相同。
本题难度:简单
3、选择题 在一定条件下,Na2CO3溶液存在水解平衡:下列说法正确的是
[? ]
A. 稀释溶液,水解平衡常数增大
B. 通入CO2,平衡向正反应方向移动
C. 升高温度,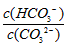 减小
减小
D. 加入NaOH固体,溶液PH减小
参考答案:B
本题解析:
本题难度:一般
4、选择题 常温下,关于下列各溶液的叙述正确的是
A.pH=7的醋酸钠和醋酸的混合溶液中:c(CH3COO-)>c(Na+)
B.0.1mol/L稀醋酸pH=a,0.01mol/L的稀醋酸pH=b,则a+1=b
C.0.1mol/L的醋酸钠溶液20mL与0.1mol/L的盐酸10mL混合后溶液显酸性:c(CH3COOH)-c(CH3COO-)=2[c(OH-)-c(H+)]
D.已知酸性HF>CH3COOH,pH相等的NaF溶液与CH3COOK溶液中:[c(Na+)-c(F-)] >[c(K+)-c(CH3COO-)]
参考答案:C
本题解析: A、醋酸钠与醋酸混合溶液中电荷守恒式为c(Na+)+c(H+)=c(CH3COO-)+c(OH-),因pH=7,所以c(CH3COO-)=c(Na+),错误;B、醋酸溶液浓度越大,电离度越小,所以a+1>b,错误;C、0.1mol/L的醋酸钠溶液20mL与0.1mol/L的盐酸10mL混合后电荷守恒式为c(Na+)+c(H+)=c(CH3COO-)+c(OH-)+c(Cl-)、物料守恒式为c(CH3COO-)+c(CH3COOH)=c(Na+)。其中c(Na+)=2c(Cl-),将电荷守恒式乘以2与物料守恒式相加得c(CH3COOH)+2c(H+)=c(CH3COO-)+2c(OH-),正确;D、NaF和CH3COOK溶液中电荷守恒式分别为c(Na+)+c(H+)=c(F-)+c(OH-)、c(K+)+c(H+)=c(CH3COO-)+c(OH-),因两溶液pH相等,所以c(H+)和c(OH-)分别相等,所以[c(Na+)-c(F-)]=[c(K+)-c(CH3COO-)],错误。
本题难度:困难
5、填空题 (10分)某温度下0.1 mol·L-1Na2CO3溶液中,c(Na+)/c(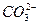 )=20/9>2,其原因是(用离子方程式表示,下同)_________。现向Na2CO3溶液中通入一定量的CO2后,c(Na+)/c(
)=20/9>2,其原因是(用离子方程式表示,下同)_________。现向Na2CO3溶液中通入一定量的CO2后,c(Na+)/c(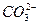 )=5/2>20/9,其原因是_________,此时c(
)=5/2>20/9,其原因是_________,此时c(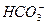 )=_________。
)=_________。
参考答案: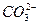 +H2O
+H2O
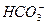 +OH-?
+OH-?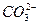 +CO2+H2O====
+CO2+H2O====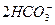 ? 0.04 mol·L-1
? 0.04 mol·L-1
本题解析: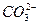 发生水解:
发生水解: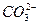 +H2O
+H2O
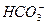 +OH-,导致c(
+OH-,导致c(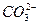 )减少。通入CO2后,发生
)减少。通入CO2后,发生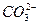 +CO2+H2O====
+CO2+H2O====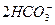 ,导致c(
,导致c(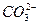 )较大程度地减少。因c(Na+)="0.2" mol·L-1,由c(Na+)/c(
)较大程度地减少。因c(Na+)="0.2" mol·L-1,由c(Na+)/c(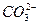 )=5/2得溶液中c(
)=5/2得溶液中c(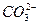 )="0.08" mol·L-1,说明反应消耗的c(
)="0.08" mol·L-1,说明反应消耗的c(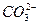 )="0.02" mol·L-1,由
)="0.02" mol·L-1,由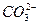 +CO2+H2O====
+CO2+H2O====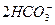 得c(
得c(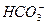 )=0.04 mol·L-1。
)=0.04 mol·L-1。
本题难度:简单