1、选择题 经测定,某溶液中只含有NH4+、Cl-、H+、OH-四种离子,且离子浓度大小的排列顺序c(NH4+)>c(Cl-)>c(OH-)>c(H+)。其可能的情形是
A.在NH4 Cl溶液中加入适量氨水至PH="7"
Cl溶液中加入适量氨水至PH="7"
B.同物质的量浓度的NH4Cl溶液与HCl液体等体积混合
C.PH=11的氨水与PH=3的HCl溶液等体积混合
D.同物质 的量浓度的HCl的溶液与氨水等体积混合
的量浓度的HCl的溶液与氨水等体积混合
参考答案:C
本题解析:略
本题难度:一般
2、选择题 下列各组物质混合后,再加热蒸干并在300℃时充分灼烧至质量不变,最终一定能得到纯净物的是( )
A.向FeSO4溶液中通入过量Cl2
B.向NaHCO3溶液中加入一定质量的Na2O2粉末
C.向NaI和NaBr混合溶液中通入过量Cl2
D.向NaOH溶液中加入过量AlCl3
参考答案:C
本题解析:向FeSO4溶液中通入过量Cl2,得到FeCl3溶液和Fe2(SO4)3加热蒸干灼烧后得到Fe2(SO4)3和Fe2O3不是纯净物。向NaHCO3溶液中加入一定质量的Na2O2粉末后,溶液可能变成Na2CO3和NaOH,加热蒸干灼烧后不一定得到纯净物。向NaI和NaBr混合溶液中通入过量Cl2,得到NaCl、Br2、I2,加热蒸干灼烧后得到NaCl。向NaOH溶液中加入过量AlCl3会得到NaAlO2和AlCl3溶液,加热蒸干灼烧后得到NaAlO2和Al2O3固体。所以能得到纯净物的是C。
点评:挥发性酸的弱碱盐,加热蒸干灼烧后得到氧化物,如AlCl3溶液加热蒸干灼烧后得到Al2O3,不挥发性酸的弱碱盐,加热蒸干灼烧后得到的还是原物质,如Al2(SO4)3溶液加热蒸干灼烧后得到的还是Al2(SO4)3。
本题难度:一般
3、选择题 下列有关溶液中微粒的物质的量浓度关系正确的是?(?)
A.0.1mol/L(NH4)2Fe(SO4)2溶液中:c(NH4+)+c(NH3·H2O)+c(Fe2+)=0.3mol/L
B.0.1mol/LNaHCO3溶液中:c(Na+)> c(CO32-)> c(OH-)> c(H+)
C.0.1mol/L某弱酸盐NaA溶液与0.05mol/L盐酸等体积混合后呈碱性的溶液中:
c(HA)> c(Cl-)> c(A-)> c(OH-)
D.等物质的量的NaHS、Na2S混合溶液中:2c(H+)+c(HS-)+3c(H2S)=c(S2-)+2c(OH?-)
参考答案:CD
本题解析:A不正确,不符合物料守恒,应该是c(NH4+)+c(NH3·H2O)+c(Fe2+)+c[Fe(OH)2]=0.3mol/L;碳酸氢钠溶液中水解程度大于电离程度,则c(Na+)> c(OH-)> c(CO32-)> c(H+),B不正确;
C中生成物是HA,另外NaA过量,溶液显碱性。这说明水解程度大于电离程度,C正确;根据物料守恒和电荷守恒可知,选项D正确,答案选CD。
点评:该题是高考中的常见题型,属于中等难度的试题。试题贴近高考,综合性强,该类试题的关键是利用好几种守恒关系,即电荷守恒、物料守恒以及质子守恒。
本题难度:一般
4、选择题 有四种物质的量浓度相等、且都由一价阳离子A+和B+及一价阴离子X-和Y-组成的盐
溶液。据测定常温下AX和BY溶液的pH=7,AY溶液的pH>7,BX溶液的pH<7,由此判断不水解的盐是(?)
A.BX
B.AX
C.AY
D.BY
参考答案:B
本题解析:AY溶液的pH>7,说明AY为强碱弱酸盐,BX溶液的pH<7,说明BX为强酸弱碱盐,则AX为强酸强碱盐,不能发生水解,B对。
本题难度:一般
5、选择题 下列溶液中各微粒的浓度关系不正确的是(? )
A.0.1 mol·L-1 HCOOH溶液中:c(HCOO-)+c(OH-)=c(H+)
B.1 L 0.l mol·L-1CuSO4·(NH4)2SO4·6H2O溶液中:
c(SO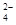 )>c(NH
)>c(NH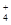 )>c(Cu2+)>c(H+)>c(OH-)
)>c(Cu2+)>c(H+)>c(OH-)
C.等体积、等物质的量浓度的醋酸和醋酸钠混合后的溶液中:
c(CH3COO-)>c(Na+) >c(H+)>c(OH-)
D.0.1 mol·L-1NaHCO3溶液中:c(Na+)+c(H+)+c(H2CO3)=c(CO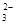 )+c(OH-)
)+c(OH-)
参考答案:D
本题解析:A 正确,符合电荷守恒
B 正确,氨根离子、硫酸根离子物质的量相等,但由于氨根离子水解,使氨根离子浓度小于硫酸根离子浓度,先考虑溶质,再考虑水电离出的c(H+)、c(OH-),由于氨根离子、铜离子水解,溶液显酸性,c(H+)>c(OH-)
C 正确,溶液显酸性,c(H+)>c(OH-),根据电荷守恒,c(CH3COO-)>c(Na+)
D 错误,c(Na+)+c(H+) =2c(CO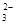 )+c(OH-)+ c(HCO3-)
)+c(OH-)+ c(HCO3-)
本题难度:一般