1、填空题 大理石中含有的主要杂质是氧化铁,以下是某化学兴趣小组用大理石为原料制取安全无毒杀菌剂过氧化钙的主要流程:
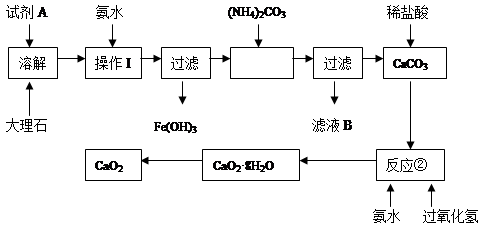
请回答下列问题:
(1)试剂A的名称是?;
(2)操作I的目的是?;
(3)本实验需要多次使用过滤,过滤中“一贴”“二低”“三靠”,其中“二低”指?;
(4)写出反应②中生成CaO2·8H2O的化学方程式:?;
参考答案:(1)硝酸或盐酸(2分)?
(2)调节溶液的pH,使Fe3+完全沉淀(2分)
(3)滤纸顶部低于漏斗口、水面低于滤纸顶部(2分)
(4)CaC12 + H2O2 + 2NH3 + 8H2O ═ CaO2·8H2O↓ + 2NH4Cl (2分)
本题解析:本题是通过除去大理石中氧化铁制备过氧化钙的流程,溶解大理石需要用稀硝酸或盐酸,加入氨水显然是生成氢氧化铁过滤去除。反应②加入的反应物为氨水、过氧化氢及氯化钙,故反应为CaC12 + H2O2 + 2NH3 + 8H2O ═ CaO2·8H2O↓ + 2NH4Cl 。
本题难度:一般
2、选择题 下列实验中,合理的是(? )
A.分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
B.用100mL 量筒量取5.20mL 盐酸
C .用托盘天平称取25.20g NaCl固体
.用托盘天平称取25.20g NaCl固体
D.用100mL 容量瓶配制125mL 0.1mol·L-1盐酸
参考答案:A
本题解析:略
本题难度:简单
3、实验题 某学习小组的三位同学为测定镀锌铁皮的镀层的厚度,提出了各自的设计方案。(忽略锌镀层的氧化)甲同学的方案:先用盐酸将镀锌铁皮表面的锌反应掉,通过差量计算出锌的质量,然后再由锌的密度算出锌层的体积,最后由体积除以镀锌铁皮的面积计算得到锌层的厚度。
(1)甲同学的方案是否可行,说出理由:?。
乙同学的方案:通过查阅资料,知道Zn(OH)2既可以与酸也可与碱反应,于是设计了如下方案:

(2)配制5%的盐酸1 L (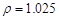 g/cm3 ),需取用36.5% (
g/cm3 ),需取用36.5% (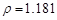 g/cm3 )的盐酸?mL
g/cm3 )的盐酸?mL
(保留一位小数)。
(3)若使用的镀锌铁皮的质量为28.357g,最后称得灼烧后固体的质量为40.000g,镀锌铁皮的长5.00cm,宽5.00cm,锌的密度为7.14g/cm3,则锌层的厚度为?cm。丙同学的方案:通过如图所示装置,测量镀锌铁皮与稀H2SO4反应产生气体的质量来计算锌层的厚度。己称得镀锌铁皮质量为18.200g。

(4)实验所用称量仪器为?。
(5)若改用浓盐酸,则测出锌的厚度会?(填“偏大”、“偏小”、或“无影响”)。
(6)实验后,将乙同学和丙同学的结果进行比较,发现他们对同种镀锌铁皮的测量结果差异很大,你认为谁的方案更加可靠呢??理由是:?。
参考答案:
(1)不可行?(1分)? Fe也会和盐酸反应? (1分)?
(2)118.9?(2分)?(3)0.001?(2分)
(4)电子天平 ?(2分)?(5)偏小? (2分)
(6)乙 ?(1分)?丙的方案中气体会带走水蒸气,易造成干扰。(1分)
本题解析:
(2)解:设用36.5% (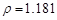 g/cm3 )的盐酸体积为X?
g/cm3 )的盐酸体积为X?
根据溶质不变:1.025*1000*5%=1.181*X*36.5%? X=118.9?
(3)解:设铁的质量为y
2Fe------- Fe2O3
112?160
y? 40.0? y="28"
锌层的厚度:(m总-m铁)/p锌/5*5="(28.357-28)/" 7.14g*5*5=0.002(cm)因为镀上下两面,各面都是0.001 cm.
(5)偏小,因为盐酸挥发,损失一部分酸,根据酸量计算的锌量小。
(6)丙的方案是根据质量差来计算锌量,气体会带走水蒸气,造成的质量差误差很大。
本题难度:一般
4、选择题 下列实验现象或结论错误的是
选项
| 实?验
| 现象或结论
|
A
| 取少量某溶液,滴加过量的稀盐酸无明显现象,再滴加BaCl2溶液
| 出现白色沉淀,则该溶液中含有SO42-
|
B
| 相同温度下,取两份等质量的锌粒分别与足量稀酸反应,向其中一份中加入几滴CuSO4溶液
| 加入ZnSO4溶液的产生氢气快,最终二者生成氢气的量相同
|
C
| 相同温度下,等质量的大理石与等体积、等浓度的盐酸反应
| 反应速率:粉状大理石>块状大理石
|
D
| 向Na2S溶液中滴入ZnSO4溶液有白色沉淀生成,再加入几滴ZnSO4溶液
| 沉淀由白色转化为黑色,说明溶度积(Ksp):ZnS>CuS
|
?
参考答案:B
本题解析: B项,滴加过 CuSO4溶液的样品由于一部分锌置换了CuSO4中的铜,形成原电池,使反应速率加快,但产生氢气的量减少。
本题难度:一般
5、选择题 下列实验操作,正确的是(?)
①制备Fe(0H)2胶体,通常是将Fe(0H)3固体溶于沸水中。
②实验中需2mol/LNa2CO3的溶液950mL,配制时应选用500mL容量瓶配制两次。
③为了除去硝酸钾溶液中含有的少量硝酸钡杂质,可以加入过量的碳酸钾溶液,过滤?后除去沉淀,在滤液中加入适量硝酸调至溶液的pH为7。
④用浓氨水洗涤做过银镜反应的试管
⑤为测定熔融氢氧化钠的导电性,可在瓷坩埚中熔化氢氧化钠固体后进行测量
⑥用分液漏斗分离苯和水的混合物时,应注意,分液漏斗中的下层液体从下口放出,
上层液体从上口倒出。
A.③⑥? B.②⑤⑥? C.④⑤? D以上都不正确
参考答案:A
本题解析:①制备Fe(0H)3胶体,通常是将1mol/LFeCl3溶液滴入沸水中,继续加热制得。所以A错。
②需2mol/LNa2CO3的溶液950mL,配制时应选用1000mL容量瓶,一次制得。所以B错
③除去硝酸钾溶液中硝酸钡杂质,可以加入过量的碳酸钾溶液,生成碳酸钡沉淀,过滤,在滤液中加入适量硝酸除去过量的NO3-,然后调至溶液的pH为7。正确;
④用浓氨水与银不反应。错误
⑤瓷坩埚的成分有SiO2.能与熔融氢氧化钠反应。错误
⑥用分液漏斗分离互不相溶的混合物时,遵循“上上下下”的原则,即分液漏斗中的上层液体从上口倒出,下层液体从下口放出 。正确。
本题难度:一般