1、实验题 绿矾(FeSO4?7H2O)是治疗缺铁性贫血的特效药。某学校的化学兴趣小组的同学对绿矾进行了如下的探究:
FeSO4?7H2O的制备
该化学兴趣小组的同学在实验室通过如下实验由废铁屑(含少量氧化铜、氧化铁等杂质)制备FeSO4·7H2O晶体:
①将5%Na2CO3溶液加入到盛有一定量废铁屑的烧杯中,加热数分钟,用倾析法除去
Na2CO3溶液,然后将废铁屑用水洗涤2~3遍。
②向洗涤过的废铁屑中加入过量的稀硫酸,控制温度在50~80℃之间至铁屑耗尽;
③趁热过滤,将滤液转入到密闭容器中,静置、冷却结晶;
④待结晶完毕后,滤出晶体,用少量冰水洗涤2~3次,再用滤纸将晶体吸干;
⑤将制得的FeSO4·7H2O晶体放在一个小广口瓶中,密闭保存。
请回答下列问题:
(1)实验步骤①的目的是 。
(2)实验步骤②明显不合理,理由是 。
(3)为了洗涤除去晶体表面附着的硫酸等杂质,实验步骤④中用少量冰水洗涤晶体,原因是 。
(二)探究绿矾(FeSO4·7H2O)热分解的产物
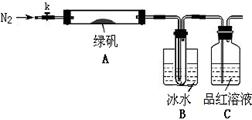
已知SO3的熔点是16.8°C,沸点是44.8°C,该小组设计如下图所示的实验装置(图中加热、夹持仪器等均省略):
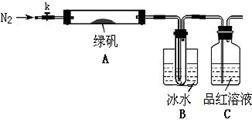
【实验过程】
①仪器连接后,检查装置A与B气密性;
②取一定量绿矾固体置于A中,通入N2以驱尽装置内的空气,关闭k,用酒精灯加热硬质玻璃管;
③观察到A 中固体逐渐变红棕色,B中试管收集到无色液体,C中溶液褪色;
④待A中反应完全并冷却至室温后,取少量反应后固体于试管中,加入硫酸溶解,取少量滴入几滴KSCN溶液,溶液变红色;
⑤往B装置的试管中滴入几滴BaCl2溶液,溶液变浑浊。
(4)实验结果分析
结论1:B中收集到的液体是?;
结论2:C中溶液褪色,可推知产物中有?;
结论3:综合分析上述实验③和④可推知固体产物一定有Fe2O3。
【实验反思】
(5)请指出该小组设计的实验装置的明显不足:?。
(6)分解后的固体中可能含有少量FeO,取上述实验④中盐酸溶解后的溶液少许于试管中,选用一种试剂鉴别,该试剂最合适的是?。
a.氯水和KSCN溶液? b.酸性KMnO4溶液? c.H2O2? d.NaOH溶液
参考答案:(1)除油污;
(2)应该铁屑过量(或反应后溶液中必须有铁剩余),否则溶液中可能有Fe3+存在;
(3)用冰水洗涤可降低洗涤过程中FeSO4·7H2O的损耗;
(4)H2SO4溶液、SO2;
(5)在C装置后增加一套尾气处理装置;?
(6)b。
本题解析:(1)碳酸钠溶液与废铁屑的成分均不能反应,故只起去油污的作用;(2)结合废铁屑的成分和后边的步骤可知,必须保证铁有剩余,才能保证溶液中没有铁离子;(3)降低温度,减小绿矾的溶解度;(4)硫酸亚铁晶体受热有水蒸汽生成,根据三氧化硫的熔点可知,冰水能将三氧化硫和水液化,在B中反应生成硫酸;C中是生成的二氧化硫使品红溶液褪色;(5)二氧化硫要进行尾气处理;(6)固体中有氧化铁,溶于盐酸后有三价铁生成,要想检验二价铁的存在,需利用亚铁离子的还原性,使酸性高锰酸钾溶液褪色,故选b。
本题难度:困难
2、选择题 将铁屑溶于滴有KSCN溶液的过量盐酸后,再加入下列物质,溶液呈红色的是
A.硫酸
B.碘水
C.硝酸锌
D.氯化铜
参考答案:C
本题解析:略
本题难度:简单
3、选择题 将质量为m g的铁粉与铜粉的混合物,溶于100mL 4mol·L-1 HNO3溶液(过量),充分反应后所得还原产物为0.05mol NO,再向所得溶液中加入足量的NaOH溶液至沉淀完全,则沉淀质量为
A.5.52g
B.(m+6.8)g
C.(m+2.55)g
D.(m+12.0)g
参考答案:C
本题解析:所得还原产物为0.05mol NO,所以转移的电子数就是0.15mol,铁粉与铜粉共失去0.15mol电子,带0.15mol的正电荷,所以要结合0.15mol氢氧根离子,沉淀质量为铁粉与铜粉的质量mg+0.15mol氢氧根离子,即为(m+2.55)g,故选C。
本题难度:简单
4、实验题 (6分)按图中所示装置,用两种不同操作分别进行实验.回答有关问题:
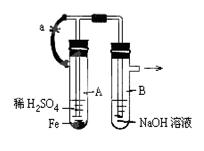
(1)按图示连接好装置,打开止水夹a,在B中可观察到的现象是?,
A中发生反应的化学方程式是?;
(2)反应片刻后,夹紧止水夹a,此时可观察到的现象有:__?__,B中发生反应的离子方程式是:?。
参考答案::(1)有无色气泡产生,Fe+H2SO4= FeSO4+H2↑;
(2)A中的溶液进入B中有白色沉淀产生,Fe2++2OH-= Fe(OH)2↓
本题解析:(1)A中发生反应Fe+H2SO4= FeSO4+H2↑,打开止水夹a,H2进入B中,则B中可看到有无色气泡产生。
(2)夹紧止水夹a后,A中气体压强增大,把FeSO4压至B中与氢氧化钠反应,则可看到B中有白色沉淀产生。离子方程式:Fe2++2OH-= Fe(OH)2。
点评:掌握铁的氢氧化物的制备方法。
本题难度:一般
5、填空题 用含少量铁的氧化物的氧化铜制取氯化铜晶体(CuCl2 xH2O)。有如下操作:
xH2O)。有如下操作:
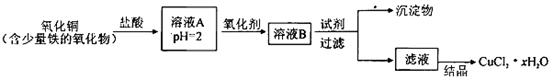
已知:在pH为4~5时,Fe3+几乎完全水解而沉淀,而此时Cu2+却几乎不水解。
(1)溶液A中的金属离子有Fe3+、Fe2+、Cu2+。检验溶液A中Fe2+的最佳试剂为_____(填编号,下同)。
①KMnO4?②(NH4)2S?③NaOH?④ KSCN
(2)氧化剂可选用_________。①Cl2?②KMnO4?③HNO3?④H2O2
(3)要得到较纯的产品,试剂可选用_______________。①NaOH ②FeO ③CuO ④Cu2(OH)2CO3
(4)从滤液经过结晶得到氯化铜晶体的方法是_____________(按实验先后顺序选填编号)。
①过滤 ②蒸发浓缩 ③蒸发至干 ④冷却
(5)欲测定溶液A中的Fe2+的浓度,实验前,首先要配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻璃棒、烧杯、药匙、胶头滴管外,还需_________,下列滴定方式中,最合理的是___________(夹持部分略去)(填字母序号)。

(6)为了测定制得的氯化铜晶体(CuCl2 xH2O)中的x值,某学生设计了两种实验方案:
xH2O)中的x值,某学生设计了两种实验方案:
方案一:称取mg晶体灼烧至质量不再减轻为止,冷却、称量所得无水CuCl2的质量为n1g
方案二:称取mg晶体溶于水,加入足量氢氧化钠溶液、过滤、沉淀洗涤后用小火加热至质量不再减轻为止,冷却,称量所得固体的质量为n2g。
试评价上述两种实验方案:其中正确的方案是________,理由是___________,据此计算得x=_________(用含m、n1或n2的代数式表示)。
参考答案:(1)①(2分) (2)①④(2分) (3)③④(2分) (4)②③①(2分)
(5)250ml容量瓶(2分);b(2分) (6)二(2分);晶体灼烧时,结晶水失去时,会形成溶液,促进CuCl2水解(2分);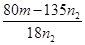 (2分)
(2分)
本题解析:(1)亚铁离子具有还原性,能使酸性高锰酸钾溶液褪色,可以用酸性高锰酸钾溶液检验亚铁离子,①正确。(NH4)2S或NaOH与三种金属阳离子均反应不能检验亚铁离子,KSCN溶液只能检验铁离子,因此②③④均不正确,答案选①。
(2)由于在氧化亚铁离子时不能再引入新的杂质,氯气的还原产物是氯离子,双氧水的生成物是水,所以①④正确;氧化剂高锰酸钾会引入Mn2+、K+以及MnO4-,硝酸会引入NO3-,②③不正确,答案选①④。
(3)在调节pH值形成氢氧化铁沉淀时,仍然不能引入新的杂质。氢氧化钠会引入钠离子,氧化亚铁会引入亚铁离子,氧化铜和碱式碳酸铜与酸反应生成铜离子、水、CO2不会引入杂质,因此答案选③④。
(4)氯化铜易溶于水,所以从滤液经过结晶得到氯化铜晶体的方法是蒸发浓缩、冷却结晶然后过滤即可,因此答案选②③①。
(5)要配制一定物质的量浓度的KMnO4溶液250mL,则除了需要天平、玻璃棒、烧杯、药匙、胶头滴管外,还需要250ml容量瓶。酸性高锰酸钾溶液具有强氧化性与酸性,应该放在酸式滴定管中,因此答案选b。
(6)由于氯化铜是强酸弱碱盐,铜离子易水解生成氢氧化铜与氯化氢,水解吸热,且生成的氯化氢具有挥发,所以晶体灼烧时,结晶水失去时,会形成溶液,促进CuCl2水解,因此方案一是错误的,方案二正确。n2g固体是氧化铜,物质的量是 mol,则根据铜原子守恒可知氯化铜晶体的物质的量是
mol,则根据铜原子守恒可知氯化铜晶体的物质的量是 mol,则
mol,则 mol×(135+18x)g/mol=mg,解得x=
mol×(135+18x)g/mol=mg,解得x=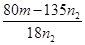 。
。
本题难度:一般