1、填空题 部分弱酸的电离平衡常数如下表:
弱酸
| HCOOH
| HClO
| H2CO3
| H2SO3
|
电离平衡常数
(25℃)
| 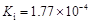
| 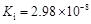
| 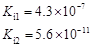
| 
|
?
(1)在温度相同时,各弱酸的Ki值与酸性的相对强弱的关系为:________________________。
(2)下列离子方程式正确的是
A.2ClO- + H2O + CO2?→ 2HClO + CO32-
B.2HCOOH + CO3?2- → 2HCOO- + H2O + CO2↑
C.H2SO3 + 2HCOO- → 2HCOOH + SO32-
D.Cl2 + H2O+2CO32- → 2HCO3- + Cl- + ClO-
(3)常温下,pH=3的HCOOH溶液与pH=11的NaOH溶液等体积混合后,溶液中离子浓度由大到小的顺序为 。
亚硒酸(H2SeO3)也是一种二元弱酸,常温下是一种无色固体,易溶于水,有较强的氧化性。
(4)往亚硒酸溶液中不断通入SO2会产生红褐色单质,写出该反应的化学方程式: ? 。
(5)将亚硒酸与30%的H2O2加热可制得硒酸(H2SeO4),反应方程式如下:
H2SeO3 + H2O2 → H2SeO4+H2O,下列说法中正确的是…………………………………( )
A.H2O2既是氧化剂又是还原剂
B.H2O 既不是氧化产物又不是还原产物
C.H2SeO4既是氧化产物又是还原产物
D.氧化性:H2SeO3>H2SeO4
碲酸(H6TeO6)是一种很弱的酸,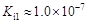 ,但它的氧化性比硫酸还要强。在酸性介质中,碲酸可将HI氧化成I2,方程式如下:
,但它的氧化性比硫酸还要强。在酸性介质中,碲酸可将HI氧化成I2,方程式如下:
HI+ H6TeO6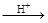 TeO2+ Te+ I2+ H2O
TeO2+ Te+ I2+ H2O
(6)若反应中生成的TeO2与Te的物质的量之比为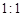 ,试配平上述化学方程式。
,试配平上述化学方程式。
参考答案:(1)Ki值越大,酸性越强 (2分,合理给分)
(2)BD? (2分)
(3)C(HCOO—)>C(Na+)>C(H+)>C(OH—) (2分)
(4)H2SeO3 + 2SO2 +H2O → Se ↓+ 2H2SO4 (2分)
(5)C (2分)
(6)8HI + 2H6TeO6 → TeO2 + Te +4I2 + 10H2O (2分)
本题解析:(1)在温度相同时,各弱酸的Ki值与酸性的相对强弱的关系为.Ki值越大,表示电离出氢离子的程度越大,则酸性越强。
(2)根据电离平衡常数可知A正确的是ClO- + H2O + CO2?→ HClO + HCO3-,错误。B正确。C.H2SO3 + HCOO- → HCOOH + HSO3- ,错误。D.Cl2 + H2O+2CO32- → 2HCO3- + Cl- + ClO-,正确。
(3)常温下,pH=3的HCOOH溶液与pH=11的NaOH溶液等体积混合后,生成HCOONa,由于甲酸是弱酸相当于有剩余,故混和液呈酸性,HCOOH电离程度大于甲酸根的水解程度,故溶液中离子浓度由大到小的顺序为C(HCOO—)>C(Na+)>C(H+)>C(OH—)。
(4)由信息:亚硒酸(H2SeO3)有较强的氧化性。SO2具有还原性,会产生红褐色单质应该是硒单质,则该反应的化学方程式:H2SeO3 + 2SO2 +H2O → Se ↓+ 2H2SO4。
(5)将亚硒酸与30%的H2O2加热可制得硒酸(H2SeO4),此时过氧化氢做氧化剂,则H2SeO4既是氧化产物又是还原产物。
(6)根据化合价升降法和题目中的信息:TeO2与Te的物质的量之比为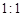 ,配平方程式为8HI + 2H6TeO6 → TeO2 + Te +4I2 + 10H2O。
,配平方程式为8HI + 2H6TeO6 → TeO2 + Te +4I2 + 10H2O。
本题难度:一般
2、填空题 氮化硅(Si3N4)是一种新型陶瓷材料,它可用石英与焦炭在高温的氮气流中反应制得:?SiO2?+??C? +??N2 ?Si3N4?+??CO?
?Si3N4?+??CO?
根据题意完成下列各题:
(1)配平上述化学反应方程式。
(2)为了保证石英和焦炭尽可能的转化,氮气要适当过量。某次反应用了20mol氮气,反应生成了5mol一氧化碳,此时混合气体的平均相对分子质量是?。
(3)分析反应可推测碳、氮气的氧化性:C?N2(填“>”“<”“=”)。
参考答案:(6分)(1) 3 SiO2?+? 6 C? +? 2 N2 1 Si3N4?+? 6 CO
1 Si3N4?+? 6 CO
(2)? 28?(3)C? <? N2
本题解析:(1)由产物CO可知,SiO2与C化学计量数之比为1:2 由产物Si3N4可知SiO2与N2化学计量数之比为3:2,所以SiO2、C、N2化学计量数之比为3:6:2,令SiO2的化学计量数为3,C、N2化学计量数分别为6、2,结合元素守恒可知Si3N4、CO化学计量数分别为1、6,配平后方程式为3SiO2+6C+2N2 Si3N4+6CO.
Si3N4+6CO.
故答案为:3、6、2、1、6.
(2)反应中只有C元素的化合价升高,氮气有剩余,根据CO计算电子转移,C元素化合价由0价升高为+2价,转移电子的物质的量为CO的2倍,所以反应中转移电子数为5mol×2×NAmol-1=10NA.
N2与CO的相对分子质量都是28,所以混合气体的平均相对分子质量为28.
故答案为:10;28.
(3)反应中N2作氧化剂,C是还原剂,N2将C氧化为CO,所以氧化性C<N2.
故答案为:<。
点评:考查氧化还原反应配平及计算、氧化性还原性比较、晶体结构与性质等,难度中等,注意掌握化学方程式常用的配平方法。
本题难度:一般
3、计算题 写出符合下列条件的氧化还原反应方程式
A.一种单质氧化另一种单质
B.一种单质氧化一种化合物
C.一种化合物氧化另一种化合物
D.一种化合物氧化一种单质
参考答案:A.C+O2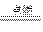 CO2, B.2CO+O2
CO2, B.2CO+O2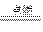 2CO2,C.MnO2+4HCl(浓)
2CO2,C.MnO2+4HCl(浓)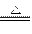 ?MnCl2+Cl2↑+2H2O,D.CuO + H2
?MnCl2+Cl2↑+2H2O,D.CuO + H2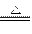 Cu+H2O。
Cu+H2O。
本题解析:本题能力层次为C。甲物质氧化乙物质时,甲物质得到电子,有元素的化合价降低,乙物质失去电子,有元素的化合价升高。
学法指导:氧化还原反应的本质是电子的转移(得失或偏移)。表现为反应前后元素的化合价发生改变,故化合价是分析氧化还原反应的基础。氧化剂具有氧化性,能氧化其他物质,含有化合价降低的元素。
本题难度:简单
4、填空题 (8分)氰(CN)2?的结构简式为N≡C—C≡N,其化学性质与卤素(X2)很相似,化学上称之为拟卤素。(CN)2?和水反应可生成HCN和HCNO;(CN)2?的氧化性比Br2弱,比I2强。
(1)下列有关反应方程式不正确的是?(填选项标号)。
A.(CN)2?和NaOH溶液反应:(CN)2? + 2OH-= CN-+ CNO-+ H2O
B.MnO2和HCN反应:MnO2 + 4HCN  ?Mn(CN)2 + (CN)2?↑ + 2H2O
?Mn(CN)2 + (CN)2?↑ + 2H2O
C.向KCN溶液中加入碘水:I2 + 2KCN =" 2KI" + (CN)2
D.在NaBr和KCN混合溶液中通入少量Cl2:Cl2 + 2Br-= 2Cl-+ Br2
(2)HCN的电子式为?。
(3)处理含CN-(其中C为+2价)的工业废水常用ClO-氧化,生成的CNO-(其中C为+4价)元素,反应的离子方程式如下:aCN-+bClO-+2cOH-=dCNO-+eN2↑+fCO32-+bCl-+cH2O,上述化学方程式可能的配平系数有多组,请回答:
①方程式中e : f的值为?(填选项标号)。
A.1? B.1/2 ? C.2 ? D.不能确定
②若d=e=1,则b=?。
参考答案:(1)CD;?(2)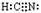 ;?(3)①B;? ②6
;?(3)①B;? ②6
本题解析:(1)根据(CN)2与水反应生成HCN和HCNO,可知(CN)2与NaOH溶液反应为(CN)2? + 2OH-= CN-+ CNO-+ H2O,A正确,根据氧化性Cl2>Br2>(CN)2>I2,可知MnO2和HCN能反应生成(CN)2?:MnO2 + 4HCN  ?Mn(CN)2+ (CN)2?↑ + 2H2O,B项正确,C、D项错误。
?Mn(CN)2+ (CN)2?↑ + 2H2O,B项正确,C、D项错误。
(2)HCN的电子式为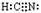 。
。
(3)根据原子守恒可知e:f=1:2。根据电荷守恒和原子守恒可知当d=e=1时,a=2,b=6,c=1,f=2。
点评:本题主要根据氧化性强弱、守恒法进行判断。
本题难度:一般
5、选择题 常温下,将等浓度的FeSO4和(NH4) 2SO4两种浓溶液混合可制得一种晶体,该晶体是分析化学中常用的一种还原剂,其强热分解反应化学方程式:2(NH4)2Fe(SO4)2·6H2O Fe2O3+2NH3↑+N2↑+4SO2↑+17H2O,下列说法正确的是
Fe2O3+2NH3↑+N2↑+4SO2↑+17H2O,下列说法正确的是
A.1 mol摩尔盐强热分解时转移电子的物质的量为8NA
B.该反应中氧化产物是N2、NH3,还原产物是SO2、Fe2O3
C.向摩尔盐溶液中滴入足量浓NaOH溶液,最终可得刺激性气体和白色沉淀
D.常温下,摩尔盐的溶解度比FeSO4、(NH4)2SO4小
参考答案:D
本题解析:根据元素化合价的变化可知,氮元素的化合价从-3价升高到0价,因此氮气是氧化产物,但氨气不是。铁的化合价从+2价升高到+3价,因此氧化铁是氧化产物,A不正确。S的化合价从+6价降低到+4价,转移2个电子,因此1 mol摩尔盐强热分解时转移电子的物质的量为4NA,B不正确。C不正确,沉淀应该是氢氧化铁,是红褐色的。等浓度的FeSO4和(NH4) 2SO4两种浓溶液混合可制得一种晶体,说明常温下,摩尔盐的溶解度比FeSO4、(NH4)2SO4小,D正确,答案选D。
本题难度:一般