1、填空题 (8分)根据下列框图回答问题(答题时,方程式中的M、E用所对应的元素符号表示):
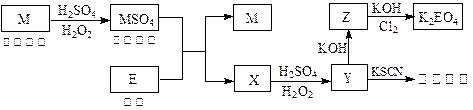
(1)写出M溶于稀H2SO4和H2O2混合液的化学方程式:?。
(2)某同学取X的溶液,酸化后加入KI、淀粉溶液,变为蓝色。写出与上述变化过程相关的离子方程式:?、?。
(3)写出Cl2将Z氧化为K2EO4的化学方程式:?。
(4)由E制备的E(C2H5)2的结构如右图,其中氢原子的化学环境完全相同。但早期人们却错误地认为它的结构为: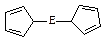 。核磁共振法能够区分这两种结构。在核磁共振氢谱中,正确的结构有?种峰,错误的结构有?种峰。
。核磁共振法能够区分这两种结构。在核磁共振氢谱中,正确的结构有?种峰,错误的结构有?种峰。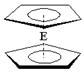
2、填空题 氮及其化合物与我们的吃、穿、住、行、健康等都有着密切的联系,也是高中化学学习中重要的一部分。请回答下列问题:
I.(1)现有一支15mL的试管,充满NO倒置于水槽中,向试管中缓缓通入一定量氧气,当试管内液面稳定时,剩余气体3mL。则通入氧气的体积可能为?。
 (2)一定条件下,某密闭容器中发生反应:4NH3(g)+5O2(g)? 4NO(g)+6H2O(g)。
(2)一定条件下,某密闭容器中发生反应:4NH3(g)+5O2(g)? 4NO(g)+6H2O(g)。
起始浓度( mol/L)
| C(NH3)
| C(O2)
| C(NO)
| C(H2O)
|
甲
| 1
| 2
| 0
| 0
|
乙
| 4
| 8
| 0
| 0
|
丙
| 0.2
| x
| y
| z
|
?
①恒温恒容下,平衡时NH3的转化率甲?乙。(填“>”、“=”、或“<”)
②恒温恒容下,若要使丙与甲平衡时各组分浓度相同,则x=?,y=?,z= ?.
(3)向容积相同、温度分别为T1和T2的两个密闭容器中分别充入等量NO2,发生反应:2NO2(g) N2O4(g)△H<0。恒温恒容下反应相同时间后,分别测定体系中NO2的百分含量分别为a1和a2;已知T1< T2,则a1_?a2。
N2O4(g)△H<0。恒温恒容下反应相同时间后,分别测定体系中NO2的百分含量分别为a1和a2;已知T1< T2,则a1_?a2。
A.大于? B.小于? C.等于? D.以上都有可能
(4)2.24L(标准状况)氨气被200 mL l mol/L HNO3溶液吸收后,反应后溶液中的离子浓度关系是?。
Ⅱ.三氟化氮(NF3)是一种新型的电子材料,它在潮湿的空气中与水蒸气能发生氧化还原反应,其生成物有HF、 NO、 HNO3。根据要求回答下列问题:
(1)写出该反应的化学方程式:?。反应过程中,氧化剂和还原剂物质的量之比为?。
(2)若反应中生成0.2mol HNO3,转移的电子数目为?。
3、填空题 (7分)氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:NO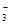 +4H++3e-→NO+2H2O
+4H++3e-→NO+2H2O
KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
(1)物质甲为 ,在该反应中作 剂。
(2)写出并配平该氧化还原反应的离子方程式: 。
(3)反应中若转移电子0.6mol,则产生气体在标准状况下的体积为 。
(4)过二硫酸钾(K2S2O8)具有强氧化性,可将I-氧化为I2:S2O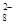 +2I-=2SO
+2I-=2SO +I2
+I2
通过改变反应途径,Fe3+、Fe2+均可催化上述反应。试用离子方程式表示Fe3+对上述反应的催化过程: 、 。
4、填空题 已知将盐酸滴入高锰酸钾溶液中,产生黄绿色气体,而溶液的紫红色褪去。现有一个氧化还原反应的体系,共有KCl、Cl2、H2SO4、H2O、KMnO4、MnSO4、K2SO4七种物质:
(1)该反应中,化合价升高的反应物是________,化合价没有发生变化的反应物是________。
(2)写出一个包含上述七种物质的氧化还原反应方程式(需配平)
__________ _____________________________________________________________。
(3)上述反应中,氧化剂是________,1 mol氧化剂在反应中________(填“得到”或“失去”)________ mol电子。
(4)如果在反应后的溶液中加入NaBiO3,溶液又显紫红色。说出NaBiO3的一个性质:
____________________________________________________。
5、选择题 离子反应、复分解反应、置换反应和氧化还原反应之间可用下列集合关系表示,其中正确的是
[? ]
A.
B.
C.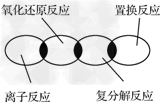
D.