1、填空题 (8分)根据下列框图回答问题(答题时,方程式中的M、E用所对应的元素符号表示):
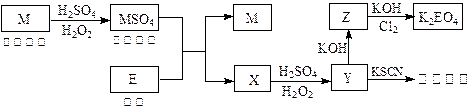
(1)写出M溶于稀H2SO4和H2O2混合液的化学方程式:?。
(2)某同学取X的溶液,酸化后加入KI、淀粉溶液,变为蓝色。写出与上述变化过程相关的离子方程式:?、?。
(3)写出Cl2将Z氧化为K2EO4的化学方程式:?。
(4)由E制备的E(C2H5)2的结构如右图,其中氢原子的化学环境完全相同。但早期人们却错误地认为它的结构为: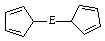 。核磁共振法能够区分这两种结构。在核磁共振氢谱中,正确的结构有?种峰,错误的结构有?种峰。
。核磁共振法能够区分这两种结构。在核磁共振氢谱中,正确的结构有?种峰,错误的结构有?种峰。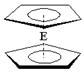
参考答案:(1)Cu + H2O2 + H2SO4 ="=" CuSO4?+ 2H2O
(2)4Fe2+ + O2 + 4H+ ="=" 4Fe3+ + 2H2O? 2Fe3+ + 2I— ="=" 2Fe2+ + I2
(3)10KOH + 3Cl2 + 2Fe(OH)3 ="=" 2K2FeO4 + 6KCl + 8H2O
(4)1? 3
本题解析:(1)红色金属为铜,与硫酸、双氧水反应生成蓝色硫酸铜溶液,双氧水作氧化剂,硫酸起酸性作用,Cu+H2O2+H2SO4=CuSO4+2H2O。
(2)根据与硫氰化钾溶液反应呈红色,Y含有Fe3+,金属E为Fe,X为FeSO4,与硫酸、双氧水生成硫酸铁,FeSO4在通常状况下也能被氧化为Fe3+,Fe3+能氧化I—,能使淀粉碘化钾试液变蓝。涉及反应:
4Fe2++O2+4H+=4Fe3++2H2O,2Fe3++2I-=2Fe2++I2。
(3)Z 为Fe(OH)3,能在碱性条件下被氯气氧化为K2FeO4,氯气被还原为KCl,根据得失电子守恒配平方程式,10KOH+3Cl2+2Fe(OH)3=2K2FeO4+6KCl+8H2O,产物中有水生成。
(4)根据题意,Fe(C5H5)2中氢原子化学环境完全相同,所以核磁共振谱只有一种信号。而错误结构根据对称性共有3种氢原子,核磁共振谱有3种峰。
本题难度:一般
2、填空题 氮及其化合物与我们的吃、穿、住、行、健康等都有着密切的联系,也是高中化学学习中重要的一部分。请回答下列问题:
I.(1)现有一支15mL的试管,充满NO倒置于水槽中,向试管中缓缓通入一定量氧气,当试管内液面稳定时,剩余气体3mL。则通入氧气的体积可能为?。
 (2)一定条件下,某密闭容器中发生反应:4NH3(g)+5O2(g)? 4NO(g)+6H2O(g)。
(2)一定条件下,某密闭容器中发生反应:4NH3(g)+5O2(g)? 4NO(g)+6H2O(g)。
起始浓度( mol/L)
| C(NH3)
| C(O2)
| C(NO)
| C(H2O)
|
甲
| 1
| 2
| 0
| 0
|
乙
| 4
| 8
| 0
| 0
|
丙
| 0.2
| x
| y
| z
|
?
①恒温恒容下,平衡时NH3的转化率甲?乙。(填“>”、“=”、或“<”)
②恒温恒容下,若要使丙与甲平衡时各组分浓度相同,则x=?,y=?,z= ?.
(3)向容积相同、温度分别为T1和T2的两个密闭容器中分别充入等量NO2,发生反应:2NO2(g) N2O4(g)△H<0。恒温恒容下反应相同时间后,分别测定体系中NO2的百分含量分别为a1和a2;已知T1< T2,则a1_?a2。
N2O4(g)△H<0。恒温恒容下反应相同时间后,分别测定体系中NO2的百分含量分别为a1和a2;已知T1< T2,则a1_?a2。
A.大于? B.小于? C.等于? D.以上都有可能
(4)2.24L(标准状况)氨气被200 mL l mol/L HNO3溶液吸收后,反应后溶液中的离子浓度关系是?。
Ⅱ.三氟化氮(NF3)是一种新型的电子材料,它在潮湿的空气中与水蒸气能发生氧化还原反应,其生成物有HF、 NO、 HNO3。根据要求回答下列问题:
(1)写出该反应的化学方程式:?。反应过程中,氧化剂和还原剂物质的量之比为?。
(2)若反应中生成0.2mol HNO3,转移的电子数目为?。
参考答案:14分)Ⅰ.(10分)(1)9mL和14.25mL(2分)
(2)①>(1分)?② 1,0.8,1.2(各1分)
(3)D(2分)
(4)c(NO-3)>c(H+)>c(NH+4)>c(OH-)(2分)
Ⅱ . (4分)
(1)3NF3+5H2O=9HF+2NO+HNO3(2分)? 2:1 (1分)
(2)2.408×1023 或0.4NA(1分)(写成物质的是不给分)
本题解析:I.(1)4NO+3O2+2H2O=4HNO3,剩余气体3mL,过量气体可能是O2或NO,若是O2过量,NO全部参加反应,根据4NO~3O2,V(O2)= 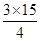 +3=14.25mL,若是NO过量,参加反应的NO为12ml,根据4NO~3O2,V(O2)=
+3=14.25mL,若是NO过量,参加反应的NO为12ml,根据4NO~3O2,V(O2)= 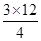 =9mL;
=9mL;
(2)①恒温恒容,乙中投料是甲中投料的4倍,等同于增大压强,平衡逆向移动,因此甲>乙;
②根据等效平衡可知,丙中转化为起始量与甲中的起始量相同,则
4NH3(g)+5O2g)?4NO(g)+6H2O(g),
起始1?2
丙 0.2? x? y? z
则0.2+y=1, x?+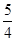 y?=2?z =
y?=2?z = 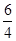 y
y
解得y?=0.8,x=1,z=1.2;
(3)恒温恒容下反应相同时间,T1<T2,两个密闭容器中分别充入等量NO2,在T1下,达到平衡时,所用时间为t1,在T2时,在t1时间时已达到平衡,因为升高温度,平衡逆向移动,所以a1>a2,选择时间小于t1,在相同时间内,在T2时,尚未达到平衡,反应正向移动,则有a1小于或等于a2,故答案为:D;
(4)2.24L(标准状况)氨气被200 mL l mol/L HNO3溶液吸收后,得到硝酸铵和硝酸的混合溶液,且二者物质的量相等,二者中都含有NO3-,它浓度最大,NH4+水解,因此C(H+)>C(NH4+),C(OH-)最小,c(NO-3)>c(H+)>c(NH+4)>c(OH-);
Ⅱ.3NF3+5H2O=9HF+2NO+HNO3,NF3既是氧化剂又是还原剂,其中N化合价是+3价,体现氧化性有2mol降到+2价,体现还原性有1mol升到+5价,氧化剂和还原剂物质的量之比为2:1,反应中每有1mol硝酸生成,转移电子2mol,若反应中生成0.2mol HNO3,转移的电子数目为0.4NA。
本题难度:困难
3、填空题 (7分)氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:NO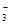 +4H++3e-→NO+2H2O
+4H++3e-→NO+2H2O
KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
(1)物质甲为 ,在该反应中作 剂。
(2)写出并配平该氧化还原反应的离子方程式: 。
(3)反应中若转移电子0.6mol,则产生气体在标准状况下的体积为 。
(4)过二硫酸钾(K2S2O8)具有强氧化性,可将I-氧化为I2:S2O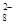 +2I-=2SO
+2I-=2SO +I2
+I2
通过改变反应途径,Fe3+、Fe2+均可催化上述反应。试用离子方程式表示Fe3+对上述反应的催化过程: 、 。
参考答案:(7分)
(1)Cu2O 还原
(2)3Cu2O+2NO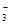 +14H+
+14H+ 6Cu2++2NO↑+7H2O(2分)
6Cu2++2NO↑+7H2O(2分)
(3)4.48L
(4)2Fe3++2I- 2Fe2++I2? 2Fe2++S2O
2Fe2++I2? 2Fe2++S2O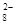
 2SO
2SO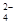 +2Fe3+
+2Fe3+
本题解析:(1)、氧化还原反应包含氧化和还原两个过程,该题中已知还原过程,对应的是氧化过程,能使还原过程发生的物质甲应该是还原剂,发生氧化过程,KMnO4、Fe2(SO4)3分别是氧化剂,Na2CO3无还原性、Cu2O具有还原性,故是Cu2O,作还原剂,(2)、可判断本题是HNO3与Cu2O发生的氧化还原反应,离子方程式3Cu2O+2NO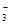 +14H+
+14H+ 6Cu2++2NO↑+7H2O(3)、转移电子0.6mol反应产生的气体只有NO,根据NO
6Cu2++2NO↑+7H2O(3)、转移电子0.6mol反应产生的气体只有NO,根据NO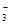 +4H++3e-→NO+2H2O,标准状态下共0.6mol/3×22.4L=4.48L(4)、反应前后催化剂的量和质均不发生改变,Fe3+有氧化性,能和具有还原性的I-反应,生成的Fe2+有还原性,再与具有强氧化性的S2O
+4H++3e-→NO+2H2O,标准状态下共0.6mol/3×22.4L=4.48L(4)、反应前后催化剂的量和质均不发生改变,Fe3+有氧化性,能和具有还原性的I-反应,生成的Fe2+有还原性,再与具有强氧化性的S2O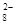 反应,反应总的过程Fe3+的量和质不变。
反应,反应总的过程Fe3+的量和质不变。
点评:对于此类试题,学生应熟悉掌握氧化还原反应的概念、本质。熟悉一些常见物质的化学性质如氧化性或还原性等
本题难度:一般
4、填空题 已知将盐酸滴入高锰酸钾溶液中,产生黄绿色气体,而溶液的紫红色褪去。现有一个氧化还原反应的体系,共有KCl、Cl2、H2SO4、H2O、KMnO4、MnSO4、K2SO4七种物质:
(1)该反应中,化合价升高的反应物是________,化合价没有发生变化的反应物是________。
(2)写出一个包含上述七种物质的氧化还原反应方程式(需配平)
__________ _____________________________________________________________。
(3)上述反应中,氧化剂是________,1 mol氧化剂在反应中________(填“得到”或“失去”)________ mol电子。
(4)如果在反应后的溶液中加入NaBiO3,溶液又显紫红色。说出NaBiO3的一个性质:
____________________________________________________。
参考答案:(1)KCl H2SO4
(2)2KMnO4+10KCl+8H2SO4=6K2SO4+2MnSO4+5Cl2↑+8H2O
(3)KMnO4 得到 5
(4)NaBiO3具有强氧化性
本题解析:根据常见的氧化剂和还原剂,可确定氧化剂为KMnO4,化合价降低,KCl为还原剂,化合价升高。
本题难度:一般
5、选择题 离子反应、复分解反应、置换反应和氧化还原反应之间可用下列集合关系表示,其中正确的是
[? ]
A.
B.
C.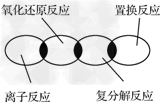
D.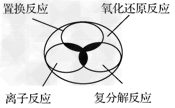
参考答案:A
本题解析:
本题难度:简单