1、填空题 (12分)右图是一个化学过程的示意图。已知甲池的总反应式为:
2CH3OH+3O2+4KOH

(1)请回答图中甲、乙两池的有关问题:甲池是?装置,B(石墨)电极的名称是?。
(2)写出电极反应式:通入O2的电极的反应式?。A(Pt)电极的反应式为?,
(3)乙池中反应的化学方程式为?。
(4)若乙池溶液体积为500mL,且忽略电解过程中溶液体积的变化,当乙池中A极的质量增加5.40g时:
①甲池中理论上消耗O?2体积为?(标准状况下);
②乙池中所得溶液的pH=?。
参考答案:
(1)原电池或化学能转变为电能的(1分),阳极(1分)
(2)O2+2H2O+4e-="=" 4OH-(2分)Ag++e-="=" Ag(2分)
(3)4AgNO3+2H2O
(4)① 280mL(2分);② 1(2分)
本题解析:略
本题难度:简单
2、填空题 (6分)在由铜片、锌片和150 mL稀硫酸组成的原电池中,当在铜片上放出6.72 L(标准状况)的H2时,硫酸恰好用完,则:
(1) 产生这些气体消耗的锌的质量是 g;
(2) 通过导线的电子的物质的量是 mol;
(3) 该原电池正极的电极反应式为 。
参考答案:(1) 19.5 (2) 0.6 (3) 2H+ + 2e- = H2↑ (每空2分,共6分)
本题解析:略
本题难度:一般
3、选择题 航天器中常使用可充电电池,构造示意图如图(氢化物电极为储氢金属,可看做H2直接参加反应)。白天太阳能帆板发电,将一部分电量储存在镍氢电池里,夜晚镍氢电池供电。下列说法正确的是( )

A.在使用过程中此电池要不断补充水
B.放电时NiOOH在电极上发生氧化反应
C.充电时阴极区电解质溶液pH升高
D.充电时阴极反应为Ni(OH)2-e-+OH-= NiOOH+H2O
参考答案:C
本题解析:A、根据题意知,该装置放电时生成水,充电时电解水,所以在使用过程中此电池不需要补充水,错误;B、放电时该装置是原电池,NiOOH在正极上得电子发生还原反应,错误;C、充电时阴极反应为NiOOH+H2O+e-=Ni(OH)2+OH-,所以阴极区电解质溶液pH升高,正确;D、充电时阴极反应为NiOOH+H2O+e-=Ni(OH)2+OH-,错误。
本题难度:一般
4、选择题 将纯锌片和纯铜片按图方式插入100mL相同浓度的稀硫酸中一段时间,下列说法正确的是( )
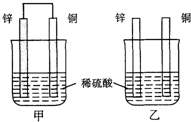
A.甲、乙均为化学能转变为电能的装置
B.乙中铜片上有气泡冒出
C.甲中铜片质量减少、乙中锌片质量减少
D.甲中电流由铜片沿导线流向锌片
参考答案:根据原电池的构成条件判断,甲是原电池,乙不是原电池.
A、甲是原电池,乙不是原电池,所以甲是把化学能转变为电能的装置,乙不是,故A错误.
B、乙中锌片上有气泡冒出,故B错误.
C、甲、乙中锌片质量都减少,故C 错误.
D、甲中电流由铜片沿导线流向锌片,电子由锌片沿导线流向铜片,故D正确.
本题解析:
本题难度:简单
5、填空题 银锌电池广泛用作各种电子仪器的电源,其电极分别是Ag2O和锌,电解液为KOH溶液。电池反应是:Ag2O+Zn+H2O="2Ag" +Zn(OH)2,根据上述判断:
(1)原电池的正极是__________,负极是__________。
(2)原电池电极反应式为:负极_______________,正极______________。
(3)工作时原电池负极附近溶液的pH__________ (填“增大”、“不变”、“减小”)。
参考答案:(5分)(1)Ag2O,? Zn。
(2)Zn+ 2OH--2e-=Zn(OH)2;Ag2O+H2O+2e-=2Ag+ 2OH-。?(3)减小
本题解析:(1)原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应。根据方程式可知,锌失去电子,作负极。氧化银得到电子,做正极。
(2)负极锌失去电子,电极反应式是Zn+ 2OH--2e-=Zn(OH)2。正极氧化银得到电子,电极反应式是Ag2O+H2O+2e-=2Ag+ 2OH-。
(3)根据负极电极反应式可知,工作时原电池负极消耗OH-,所以附近溶液的pH减小。
点评:该题是基础性试题的考查,侧重对学生基础知识的巩固,难度不大。该题的关键是明确原电池的工作原理,有利于培养学生的逻辑推理能力和发散思维能力。
本题难度:一般