1、选择题 已知最外层电子数相等的元素原子具有相似的化学性质。氧元素原子的核外电子分层排布示意图为 下列原子中,与氧元素原子的化学性质相似的是(? )
下列原子中,与氧元素原子的化学性质相似的是(? )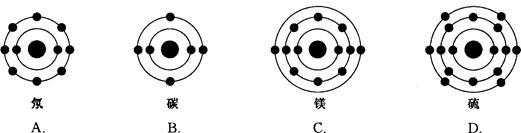
参考答案:
本题解析:由图可知,氧原子最外层电子数为6,与氧原子具有相似的化学性质的原子最外层电子数为6,A选项,碳原子最外层电子数为4,与氧原子最外层电子数不相等,故A不符合;B选项,氖原子最外层电子数为8,与氧原子最外层电子数不相等,故B不符合;C选项,镁原子最外层电子数为2,与氧原子最外层电子数不相等,故C不符合;D选项,硫原子最外层电子数为6,与氧原子最外层电子数相等,故D符合。
本题难度:一般
2、选择题 下列各项中,碱金属元素随原子序数的增加,跟卤族元素变化不一致的是?(?)
A.单质的熔沸点
B.原子半径
C.单质的密度
D.原 子的电子层数
子的电子层数
参考答案:A
本题解析:略
本题难度:一般
3、填空题 现有六种元素,其中A、B、C、D为短周期主族元素,E、F为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
A元素原子的核外p电子总数比s电子总数少1
|
B元素原子核外s电子总数与p电子总数相等,且不与A元素在同一周期
|
C原子核外所有p轨道全满或半满
|
D元素的主族序数与周期数的差为4
|
E是前四周期中电负性最小的元素
|
F在周期表的第七列
|
⑴A基态原子中能量最高的电子,其电子云在空间有?个方向,原子轨道呈?形。
⑵某同学根据上述信息,所画的B电子排布图如图 ,违背了?原理。
,违背了?原理。
⑶F位于?族?区,其基态原子有?种运动状态。
⑷CD3 中心原子的杂化方式为?,用价层电子对互斥理论推测其分子空间构型为?,检验E元素的方法是?。
⑸若某金属单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。则晶胞中该原子的配位数为?,该单质晶体中原子的堆积方式为四种基本堆积方式中的?。若已知该金属的原子半径为d cm,NA代表阿伏加德罗常数,金属的相对原子质量为M,则该晶体的密度为______g·cm-3(用字母表示)。
参考答案:⑴3,纺锤形或哑铃形(各1分)?⑵泡利不相容(1分)
⑶第VIIB? d? 25(各1分)?⑷sp3?三角锥形?焰色反应(各1分)
⑸12?铜形(或面心立方堆积)
本题解析:A元素原子的核外p电子总数比s电子总数少1,且A是短周期元素,所以A是氮元素。B元素原子核外s电子总数与p电子总数相等,且不与A元素在同一周期,原子序数大于A的,所以B是Mg元素。C原子核外所有p轨道全满或半满,且原子序数大于B元素的,则C应该是P元素。D元素的主族序数与周期数的差为4,D一定是第三周期元素,所以D是氯元素。E是前四周期中电负性最小的元素,金属性越强电负性越小,所以E是K。F在周期表的第七列,且位于第四周期,所以F是锰元素。根据乙的结构特点可知,晶胞中该原子的配位数为3×8÷2=12个。该单质晶体中原子的堆积方式为四种基本堆积方式中的铜形(或面心立方堆积)。根据丙的结构可知,该晶胞的边长是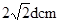 ,晶胞中含有的原子个数是
,晶胞中含有的原子个数是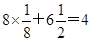 个,所以有
个,所以有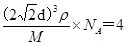 ,解得ρ=。
,解得ρ=。
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,侧重对学生能力的培养和解题方法的指导与训练,旨在考查学生灵活运用基础知识解决实际问题的能力,有利于培养学生的应试能力和逻辑推理能力。该题以“周期表中元素的推断”为载体,考查学生对元素周期表的熟悉程度及其对表中各元素性质和相应原子结构的周期性递变规律的认识和掌握程度。考查了学生对物质结构与性质关系以及运用元素周期律解决具体化学问题的能力。
本题难度:一般
4、填空题 有关元素X、Y、Z、W的信息如下:
元素
| 有关信息
|
X
| 原子半径为0.074 nm,其氢化物的结构模型可表示为:
|
Y
| 原子半径为0.102 nm,其原子核外电子排布为: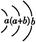
|
Z
| 人体中必需微量元素中含量最多,体内缺失会引起贫血
|
W
| 所在主族序数与所在周期序数之差为4
|
?
请回答下列问题:
(1)W在元素周期表中的位置是?。
(2)Y与W相比,非金属性较强的是?(填元素符号),下列事实能证明这一结论的是?(填字母)。
a.W元素氢化物的稳定性大于Y元素氢化物的稳定性
b.W元素氢化物水溶液的酸性强于Y元素氢化物水溶液的酸性
c.W元素的单质能与Y元素的氢化物反应,置换出Y单质
d.W的最高价含氧酸比Y的最高价含氧酸的酸性强
(3)Z元素和X元素可形成离子Z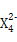 ,含该离子的盐是优良的绿色消毒剂和无机絮凝剂。
,含该离子的盐是优良的绿色消毒剂和无机絮凝剂。
①Z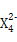 具有强氧化性,能杀菌消毒,还原产物是Z3+。
具有强氧化性,能杀菌消毒,还原产物是Z3+。
②含该离子的盐用作絮凝剂的原因是(用离子方程式和简要的文字说明)?。
参考答案:(1)第3周期ⅦA族 (2)Cl a、c、d
(3)Fe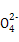 的还原产物为Fe3+,能发生水解反应,Fe3++3H2O
的还原产物为Fe3+,能发生水解反应,Fe3++3H2O Fe(OH)3(胶体)+ 3H+ ,生成的氢氧化铁胶体有吸附作用,起到净水作用
Fe(OH)3(胶体)+ 3H+ ,生成的氢氧化铁胶体有吸附作用,起到净水作用
本题解析:由X的氢化物的结构模型可知X为O;由Y的原子核外电子排布可知a=2,b=6,即Y为S;根据表中Z的有关信息可知Z为Fe;又因W所在主族序数与所在周期序数之差为4,可推知W应为Cl,故(1)Cl在第3周期ⅦA族;(2)非金属强弱的判断方法有:气态氢化物的稳定性,其最高价含氧酸的酸性强弱、非金属之间的置换反应,故a、c、d正确;(3)Z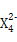 即Fe
即Fe 的还原产物为Fe3+,能发生水解反应,Fe3++3H2O
的还原产物为Fe3+,能发生水解反应,Fe3++3H2O Fe(OH)3(胶体)+3H+,生成的Fe(OH)3胶体具有吸附作用,起到净水作用。
Fe(OH)3(胶体)+3H+,生成的Fe(OH)3胶体具有吸附作用,起到净水作用。
本题难度:一般
5、填空题 M原子在第二能层上只有一个空轨道,则M是?;其电子排布式为?;R原子的3p轨道上只有一个未成对电子,则R原子可能是?、?;Y原子的核电荷数为33,其外围电子排布是?,其在元素周期表中的位置是?,是属于?区的元素。
参考答案:C? 1s22s22p2?Al? Cl? 4s24p3?第四周期第ⅤA族? P区
本题解析:M原子在第二能层上只有一个空轨道,则M的核外电子排布式是1s22s22p2.则M是C元素。R原子的3p轨道上只有一个未成对电子,则R的核外电子排布式是1s22s22p63s23p1或1s22s22p63s23p5.则该元素可能是13号元素Al或17号元素Cl.。Y原子的核电荷数为33.根据原子核外电子排布的能级图可知:其核外电子排布式是1s22s22p63s23p63d104s24p3;其外围电子排布是4s24p3.该元素在元素周期表中的位置是位于第四周期第ⅤA族,是P区的元素。
本题难度:一般