1、选择题 现有200mL MgCl2和AlCl3的混合溶液,其中c(Mg2+)=0.2mol/L,c(Cl-)=1.3mol/L,要使Mg2+转化成Mg(OH)2,并使Mg2+、Al3+分离开来,4mol/L NaOH溶液的最少用量为?(?)
A.140mL
B.120mL
C.11mL
D.80mL
参考答案:D
本题解析:略
本题难度:简单
2、填空题 Mg与H2O反应:_______________________
参考答案:Mg+2H2O=Mg(OH)2↓+H2↑
本题解析:
本题难度:简单
3、填空题 (8分)实验室中有甲、乙、丙三位学生做制备氢氧化铝实验,桌上放着 同样的药品:231g浓度为70%的硫酸,含杂质苛性钾20%的烧碱140g及足量的铝屑,三位学生分别制得氢氧化铝w1g,w2g,w3g,实验的三种方案示意图如下:
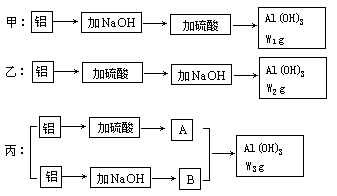
(1)从充分利用原料,降低成本和提高产率等因素分析,哪个学生实验方案最佳(用甲、乙、丙序号表示)__? _____。
(2)三位学生分别制得氢氧化铝质量大小的顺序为(用w1,w2,w3序号表示):___? ____。
参考答案:(1)丙 (2)W3>W1>W2
本题解析:略
本题难度:一般
4、计算题 (7分)向铝粉和过氧化钠的混和物中加入足量水振荡,当混和物全部溶 解后,得到无色透明溶液并放出7克气体,向该溶液中滴加5摩/升的盐酸,有白色胶状沉淀生成,当滴加到280毫升时,沉淀
解后,得到无色透明溶液并放出7克气体,向该溶液中滴加5摩/升的盐酸,有白色胶状沉淀生成,当滴加到280毫升时,沉淀 恰好溶解,求原混和物铝和过氧化钠的物质的量之比为多少?(需写出计算过程)
恰好溶解,求原混和物铝和过氧化钠的物质的量之比为多少?(需写出计算过程)
参考答案:n(Al)∶n(Na2O2)=1:2
本题解析:略
本题难度:简单
5、选择题 将5.1g镁铝合金投入到500mL2mol·L-l的盐酸中,金属完全溶解后,再加入4mol·L-1的NaOH溶液,若要使得到的沉淀量为最大值,应加入NaOH溶液的体积为( )
A.560mL
B.500mL
C.425mL
D.250mL
参考答案:D
本题解析:由
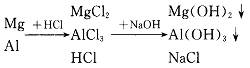
由上述分析可知:沉淀量最多时应是Mg2+、Al3+全部以沉淀形式存在的情形。显然,此时溶液中只存在NaCl,而不可能有HCl或NaOH,所以当n(Na+)=n(Cl-),也就是n(NaOH)=n(HCl)时,沉淀量最多。由此可求NaOH溶液的体积为250mL。
11.(1)[Al(OH)4]-;(2)Zn+2NaOH+2H2O=Na2[Zn(OH)4]+H2↑;(3)①③④;(4)Al3++3NH3·H2O=2Al(OH)3↓+3NH4+;可溶性锌盐与氨水反应产生的Zn(OH)2可溶于过量氨水中生成[Zn(NH3)4]2+,氨水的用量不易控制。
本题难度:简单