| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学必考知识点《键参数——键能、键长与键角》典型例题(八)
 参考答案:W的最外层电子数与质子数之比为3:8,当最外层电子数为3时,其电子排布为2、6,最外层不是3,不成立,当最外层电子数为6是,其电子排布为2、8、6,为S元素,则Y为O元素,则X为C元素,Z为Si元素: 本题解析: 本题难度:简单 2、选择题 短周期元素X、Y、Z,其中X、Y位于同一主族,Y、Z位于同一周期.X原子的最外层电子数是其电子层数的3倍,Z原子的核外电子数比Y原子少1.下列比较正确的是( ) 参考答案:D 本题解析: 本题难度:一般 3、选择题 一种由钛(Ti)原子和碳原子构成的气态团簇分子,分子模型如图所示,其中圆圈表示钛原子,黑点表示碳原子,则它的化学式为(?) 参考答案:D 本题解析:由于是气态团簇分子,属于分子晶体,即原子全部属于该晶胞,所以其化学式是 本题难度:简单 4、选择题 不锈钢的种类很多,其中一种铁元素以外,还含有较多的Cr(铬)、Ni(镍)、Mo(钼),少量的Si(硅)、C(碳),微量的S(硫)、P(磷)。 |

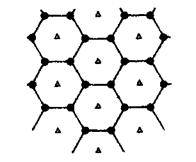
参考答案:(13分)
(1)P、S、Si(2分)
(2)4d55s1(2分)
(3)CH4与SiH4组成、结构相似,CH4的相对分子质量较小,分子间范德华力也较小,故其沸点较低(2分)
(4)A? E(2分)
(5)sp2(2分)
(6)MgC2(3分)
本题解析:(1)Si、P、S是第三周期从左到右的主族元素,则第一电离能总体递增,但是原子轨道半充满电子的P比相邻元素大,则P>S>Si;(2)基态Cr原子的价电子排布式为3d54s1,则位于第五周期的Mo原子价电子排布式为4d55s1;(3)CH4与SiH4组成、结构相似,CH4的相对分子质量较小,分子间范德华力也较小,故其沸点较低;(4)[Ni(CN)4]2—的中心离子和配体之间存在配位键、配体内C和N之间C≡N键中存在1个σ键和2个π键,不存在离子键和氢键,故AE正确;(5)C60分子中碳原子之间可以形成正六边形和正五边形,其中正六边形中∠CCC=120?,说明碳原子采取sp2杂化;(6)以任意1个正六边形为研究对象,每个顶点被相邻3个正六边形公用,每个正六边形含有的碳原子数=6×1/3=2,镁原子数为1×100%=1,则每个正六边形或材料的化学式为MgC2。
本题难度:一般
5、选择题 判断下列有关化学基本概念的依据正确的是
[? ]
A.溶液与胶体本质的不同是能否发生丁达尔效应
B.共价化合物:是否含有共价键
C.强、弱电解质:溶液的导电能力大小
D.氧化还原反应:元素化合价是否变化
参考答案:D
本题解析:
本题难度:简单
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点整理《新型材料》.. | |