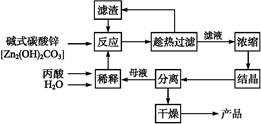
1、填空题 丙酸的结构为CH3—CH2—COOH,丙酸盐是安全有效的防霉、防腐剂,一种以碱式碳酸锌为原料的生产工艺流程如下:
序号
| n(丙酸)∶
n(碱式碳酸锌)
| 反应温度/℃
| 丙酸锌产率/%
|
1
| 1∶0.25
| 60
| 67.2
|
2
| 1∶0.25
| 80
| 83.5
|
3
| 1∶0.25
| 100
| 81.4
|
4
| 1∶0.31
| 60
| 89.2
|
5
| 1∶0.31
| 80
| 90.1
|
6
| 1∶0.31
| 100
| 88.8
|
?
(1)探究本实验中最佳工艺条件(见上表):反应时间2 h,用水量45 g,n(丙酸)∶n(碱式碳酸锌)=1∶ ,反应温度 ℃。?
,反应温度 ℃。?
(2)本工艺采用“闭路循环”方式,除具有制备工艺简便、产率高外,还具有 的优点。?
(3)某次实验时,将37.0 g丙酸溶于220 mL水中,按上述流程在上述优化的条件下制备,最终得丙酸锌49.6 g,则该次实验丙酸锌的产率为 (写出计算过程)。?
参考答案:(1)0.31 80 (3)原料利用率高,无废液、废渣排放等
(3)n(丙酸)=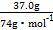 ="0.5" mol;n(丙酸锌)=
="0.5" mol;n(丙酸锌)= ="0.235" mol;产率=
="0.235" mol;产率=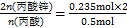 ×100%=94.0%
×100%=94.0%
本题解析:(2)评价工艺流程应从产率、原料利用率、环保、原料来源等方面进行评价;(3)应该换算成物质的量进行求解,注意2 mol CH3—CH2—COOH生成1 mol丙酸锌(CH3—CH2—COO)2Zn
本题难度:一般
2、填空题 (共12分)钛是21世纪金属。下面是利用钛白粉(TiO2)生产海绵钛(Ti)的一种工艺流程:
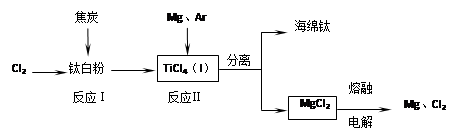
已知:① Mg(s)+Cl2 (g)=MgCl2 (s)? △H=-641 kJ·mol-1
② Cl2(g)+1/2Ti (s)=1/2TiCl4 (l)? △H=-385 kJ·mol-1
(1)钛白粉是利用TiO2+发生水解生成钛酸(H2TiO3)沉淀,再煅烧沉淀制得的。
TiO2+发生水解的离子方程式为?。
(2)反应I在800~900℃下进行,还生成一种可燃性无色气体,该反应的化学方程式为?;
反应II的热化学方程式为?。
(3)该工艺流程中,可以循环使用的物质有?(填化学式)。
(4)在800℃~1000℃时电解TiO2也可制得海绵钛,装置如右图所示。图中b是电源的?极,阴极的电极反应式为?。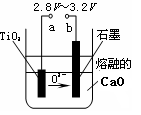
参考答案:(共12分)每空2分(1)TiO2++2H2O=H2TiO3↓+2H+(2分)
(2)TiO2+2Cl2+2C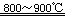
2Mg(s)+TiCl4(l)=2MgCl2(s)+Ti(s)? △H=-512 kJ·mol-1(2分,状态不写0分)
(3)Mg、Cl2(每空1分,共2分)
(4)正(2分)? TiO2+4e-=Ti+2O2-(2分)
本题解析:(1)TiO2+发生水解生成钛酸(H2TiO3)沉淀,说明水解程度很大,所以TiO2+发生水解的离子方程式为TiO2++2H2O=H2TiO3↓+2H+。
(2)根据元素的组成可知,可燃性无色气体应该是CO,所以该反应的化学方程式是TiO2+2Cl2+2C?TiCl4+2CO。根据盖斯定律可知,(①-②)×2即得到2Mg(s)+TiCl4(l)=2MgCl2(s)+Ti(s),所以该反应的反应热△H=(-641kJ/mol+385 kJ/mol)×2=-512 kJ/mol。
(3)根据转化图可知,最后氯化镁电解又生成镁和氯气,二者可以循环使用。
(4)根据装置图可知,氧离子向b电极移动,所以与b相连的电极是阳极,因此b是电源的正极。电解池中阴极是得到电子的,所以阴极电极反应式是TiO2+4e-=Ti+2O2-。
点评:本题难度不是很大,考查的知识点较多、综合性较强,考查同学们新信息获取、处理及灵活运用所学知识(化学方程式、电极反应式的书写、盖斯定律以及电源正负极的判断等)进行分析问题、解决问题的能力。重点考查学生对化学知识的熟练掌握程度,以及灵活运用知识解决实际问题的能力。
本题难度:一般
3、选择题 接触法生产H2SO4的过程中,对废气、废液、废渣和“废热”的处理正确的是
①尾气用氨水处理?②污水用石灰乳处理③废渣用来炼铁、制水泥等④将“废热”通过“废热”锅炉产生蒸气发电.
A.只有①②
B.只有①③④
C.只有①②③
D.全部
参考答案:D
本题解析:分析:依据对废气、废液、废渣和“废热”的利用和处理分析选项的正确性;
解答:①硫酸厂尾气中含有SO2,可用氨水吸收处理;2NH3+H2O+SO2=(NH4)2SO3,或NH3+H2O+SO2=NH4HSO3;故①正确;
②硫酸厂废水中含有H2SO4,可用石灰乳中和;Ca(OH)2+H2SO4═CaSO4+2H2O;故②正确;
③硫酸厂废渣中含有SiO2、Fe2O3等,可用于制造水泥、炼铁;废物利用,故③正确;
④由于硫酸生产过程中三个化学反应都是放热反应,可以充分利用这些反应放出的热能来降低生产成本;故④正确;
综上所述,答案为D;
故选D.
点评:本题考查了对废气、废液、废渣和“废热”的处理,处理的目的和应用,熟练掌握工业制备的流程,尾气的处理原则,除杂的分析应用是解题关键.
本题难度:一般
4、选择题 化学与生活密切相关,下列有关说法正确的是
[? ]
A.煤经气化和液化两个物理变化过程,可变为清洁能源
B.糖类、蛋白质、油脂都属于高分子化合物
C.维生素C具有还原性,在人体内起抗氧化作用
D.制作航天服的聚酯纤维和用于光缆通信的光导纤维都是新型无机非金属材料
参考答案:C
本题解析:
本题难度:简单
5、选择题 下面是人们对化学科学的各种常见知识的认识,其中错误的是(?)
A.化学是一门以实验为基础的自然科学;
B.化学为解决困扰现代社会的环境问题、能源问题和资源问题等提供更多的有效途径。
C.化学不支持高新技术的快速发展。
D.学好化学的关键是掌握实验方法以及完成化学实验所必需的技能。
参考答案:C
本题解析:略
本题难度:简单