1、选择题 下列有关物质的性质或用途的说法中正确的是( )
①氯气具有漂白性,可以直接使有色布条褪色 ②二氧化硫具有较强的还原性,不能用浓硫酸干燥 ③SiO2是酸性氧化物,能与氢氟酸反应 ④Al(OH)3是两性氢氧化物,能溶于强酸或强碱
A.①②③
B.②③④
C.③④
D.①②④
参考答案:C
本题解析:①Cl2本身不具有漂白性;②SO2不和浓H2SO4反应,能用浓H2SO4干燥。
本题难度:一般
2、填空题 氢气在氯气中燃烧的现象为______,生成物的结构式为______.钠在氯气中燃烧的化学方程式为______;生成物溶于水的电离方程式为______.
参考答案:氢气在氯气中燃烧H2+Cl2点燃.2HCl,生成的氯化氢气体极易溶于水,所以瓶口上方有白雾,所以燃烧的现象为:安静地燃烧、产生苍白色火焰、瓶口有白雾;
氯化氢为共价化合物,氢原子和氯原子之间共用一对电子,所以其结构式为:H-Cl;
钠在氯气中燃烧2Na+Cl2点燃.2NaCl生成氯化钠固体,氯化钠为易溶于水的强酸强碱盐,在水中能完全电离,NaCl=Na++Cl-:
故答案为:安静地燃烧、产生苍白色火焰、瓶口有白雾;H-Cl;2Na+Cl2点燃.2NaCl;NaCl=Na++Cl-;
本题解析:
本题难度:一般
3、选择题 两种金属的混合物粉末15 g,与足量的盐酸反应时,恰好得到11.2L标准状况下的氢气,下列各组金属能构成符合上述条件的混合物的是
A.Na和Ag
B.Cu和Zn
C.Al和Fe
D.Mg和Al
参考答案:C
本题解析:用平均值法:11.2 L标准状况下氢气的物质的量为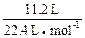 即0.5mol,得到电子为:0.5mol×2=1mol,即金属失去1mol电子的平均质量为15g,必有一物质失去1mol电子其质量大于15g,而另一种物质失去1mol电子其质量小于15g.A项:Na失1mol电子其质量为23g,Ag不反应可看成大于15g,所以A不正确.B项:Zn:
即0.5mol,得到电子为:0.5mol×2=1mol,即金属失去1mol电子的平均质量为15g,必有一物质失去1mol电子其质量大于15g,而另一种物质失去1mol电子其质量小于15g.A项:Na失1mol电子其质量为23g,Ag不反应可看成大于15g,所以A不正确.B项:Zn: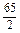 =32.5g、Cu看成大于15g.Cu、Zn均大于15g,故不符合;C项:Al:
=32.5g、Cu看成大于15g.Cu、Zn均大于15g,故不符合;C项:Al: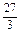 =9g、Fe:
=9g、Fe: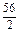 =28g,C符合.D项:Mg:
=28g,C符合.D项:Mg: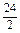 =12g、Al:9g,都小于15g,故D不符合.
=12g、Al:9g,都小于15g,故D不符合.
本题难度:一般
4、填空题 洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一。漂白粉是常用的消毒剂。
(1)工业上将氯气通入石灰乳2制取漂白粉,化学反应方程式为__________________________。
(2)漂白粉的有效成分是(填化学式)____________________。
(3)漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,化学反应
方程式为____________________________________________________。
(4)(1)和(3)的反应中,属于氧化还原反应的是(填编号)_________________________。
参考答案:(1)2Cl2+2Ca(OH)2="=" CaCl2 +Ca(ClO)2+2H2O? (2)Ca(ClO)2
(3)Ca(ClO)2 + H2O+ CO2 ="=" CaCO3↓+ 2HClO? (4) (1)
本题解析:(1)氯气溶于石灰乳中即可生成漂白粉,漂白粉的主要成分是氯化钙和次氯酸钙,方程式为2Cl2+2Ca(OH)2="=" CaCl2 +Ca(ClO)2+2H2O。
(2)漂白粉属于混合物,主要成分是次氯酸钙。
(3)碳酸的酸性强于次氯酸的,所以能和次氯酸钙反应生成次氯酸,方程式为Ca(ClO)2 + H2O+ CO2 ="=" CaCO3↓+ 2HClO。
(4)凡是有元素化合价升降的反应都是氧化还原反应,所以(1)是氧化还原反应。
本题难度:一般
5、选择题 将下列溶液分别加入到用氯气消毒过的自来水中,会产生沉淀的是
[? ]
A.AgNO3溶液?
B.NaNO3溶液?
C.NaCl溶液?
D.K2SO4溶液
参考答案:A
本题解析:
本题难度:简单