1、选择题 利用反应:2NO(g)+2CO(g)

2CO2(g)+N2(g)△H=-746.8kJ?mol-1,可净化汽车尾气,如果要同时提高该反应的速率和NO的转化率,采取的措施是( )
A.降低温度
B.及时将CO2和N2从反应体系中移走
C.升高温度同时充入N2
D.增大压强同时加催化剂
参考答案:A、降低温度,化学反应速率减慢,化学平衡向放热方向移动,即正反应方向,NO的转化率转化率增大,故A错误;
B、减少生成物的浓度,平衡向正反应方向移动,NO的转化率增大,但反应速率减小,故B错误;
C、升高温度,化学反应速率加快,化学平衡向吸热方向移动,即逆反应方向,NO的转化率转化率减小,同时充入N2,化学平衡向逆反应方向移动,NO的转化率转化率减小,故C错误;
D、增大压强,化学反应速率加快,化学平衡向气体体积减小的方向移动,即正反应方向,NO的转化率转化率增大,同时加催化剂,可以加快反应速率,但平衡不移动,故D正确;
故选:D.
本题解析:
本题难度:一般
2、填空题 (10分) 830K时,在密闭容器中发生下列可逆反应:
CO(g)+H2O(g) CO2(g)+H2(g)?△H<0
CO2(g)+H2(g)?△H<0
试回答下列问题:
(1)若起始时c(CO)="2" mol·L-1,c(H2O)="3" mol·L-1,达到平衡时CO的转化率为60%,则在该温度下,该反应的平衡常数K=?.
(2)在相同温度下,若起始时c(CO)="1" mol·L-1,c(H2O)="2" mol·L-1,反应进行一段时间后,测得H2的浓度为0.5 mol·L-1,则此时该反应是否达到平衡状态?(填“是”与“否”),此时v(正)?v(逆)(填“大于”“小于”或“等于”),你判断的依据是
?
(3)若降低温度,该反应的K值将?,该反应的化学反应速率将?(均填“增大”“减小”或“不变”)。
参考答案:(1)1(2)否、大于因为Qc= 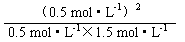 ?=
?=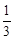 <K,平衡向右移动(3)增大?减小
<K,平衡向右移动(3)增大?减小
本题解析:(1)平衡时c(CO)="0.8" mol·L-1,c(H2O)=1.8mol·L-?c(CO2)=c(H2)="1.2" mol·L-由三部曲可以直接求算出平衡常数为1,(2)在相同温度下,若起始时c(CO)="1" mol·L-1,c(H2O)="2" mol·L-1,平衡时c(CO)="0.5" mol·L-1,c(H2O)=1.5mol·L-?c(CO2)=c(H2)="0.5" mol·L-计算此条件下的常数为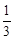 <1不是平衡状态,要向正反应方向移动。(3)若降低温度,正反应方向是吸热方向,平衡向正反应方向移动,该反应的K值将增大,降温速率减小。
<1不是平衡状态,要向正反应方向移动。(3)若降低温度,正反应方向是吸热方向,平衡向正反应方向移动,该反应的K值将增大,降温速率减小。
本题难度:一般
3、填空题 (15分)2013年以来,我国多地频现种种极端天气。二氧化碳、氮氧化物、二氧化硫是导致极端天气的重要因素。
(1)用钌的配合物作催化剂,一定条件下可直接光催化分解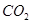 ,发生反应:
,发生反应: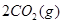 =2CO(g)+
=2CO(g)+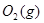 △H>0,该反应的
△H>0,该反应的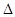 S 0(填“>”“<”或“=”),在低温下,该反应 (填“能”或“不能”)自发进行。
S 0(填“>”“<”或“=”),在低温下,该反应 (填“能”或“不能”)自发进行。
(2)活性炭可用于处理大气污染物NO。在1 L恒容密闭容器中加入0.100 mol NO和2.030 mol固体活性炭(无杂质),生成气体E和气体F。当温度分别在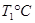 和
和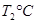 时,测得平衡时各物质的物质的量如下表:
时,测得平衡时各物质的物质的量如下表:
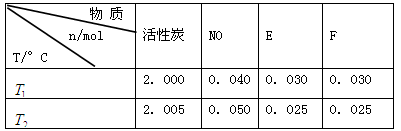
①请结合上表数据,写出NO与活性炭反应的化学方程式: 。
②上述反应在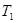 ℃时的平衡常数为
℃时的平衡常数为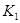 ,在
,在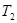 ℃时的平衡常数为
℃时的平衡常数为 。
。
计算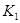 = 。根据上述信息判断,
= 。根据上述信息判断,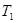 和
和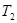 的关系是 。
的关系是 。
a.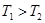 b.
b.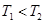 c.无法比较
c.无法比较
③在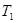 ℃下反应达到平衡后,下列措施不能改变NO的转化率的是____。
℃下反应达到平衡后,下列措施不能改变NO的转化率的是____。
a.增大c(NO) b.增大压强 c.升高温度 d.移去部分F
(3)碘循环工艺不仅能吸收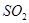 降低环境污染,同时又能制得氢气,具体流程如下:
降低环境污染,同时又能制得氢气,具体流程如下:

①用离子方程式表示反应器中发生的反应 。
②用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出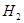 的目的是: 。
的目的是: 。
(4)开发新能源是解决大气污染的有效途径之一。直接甲醇燃料电池(简称DMFC)由于结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注。DMFC工作原理如图所示:
通过a气体的电极是原电池的 极(填“正”或“负”),其电极反应式为 。
参考答案:(15分)
(1) > 不能
(2)①C+2NO=N2+CO2 ②9/16 C ③a、b
(3) ①SO2+I2+2H2O = SO42-+2I-+4H+ ②降低生成物的浓度,使平衡向正方向移动
(4) 负 CH3OH-6e-+H2O = CO2 +6H+
本题解析:(1)根据化学反应可知,该反应是熵增的化学反应,所以△S>0,根据反应自发进行的判据,△ H-T△S<0反应能自发进行,该反应是熵增的吸热反应,在低温下不能自发进行。
(2)①根据活性炭可用于处理大气污染物NO,说明两者反应生成氮气和CO2,反应的化学方程式为C+2NO=N2+CO2;
②根据表格提供的信息,上述反应在T1℃时的平衡常数为K1(0.030×0.030)÷(0.040×0.040)=9/16,根据上述信息,没有温度大小,没有反应的热效应,无法比较T1和T2的关系,选c;③a.增大c( NO),相当于增大压强,平衡不移动,不能增大NO的转化率,b.该反应是反应前后气体体积不变的化学反应,增大压强,平衡不移动,不能增大NO的转化率,c.如果该反应是吸热反应,升高温度,平衡正向移动,能增大NO的转化率, d.移去部分F,平衡右移,能增大NO的转化率,选a、b。
(3)①根据流程图可知,SO2通入碘水中生成硫酸和氢碘酸,则反应器中发生反应的离子方程式为:SO2+I2+2H2O = SO42-+2I-+4H+,②根据化学反应2HI(g) I2(g)+H2(g),分离出H2,降低生成物的浓度,使平衡向正方向移动,加速碘的生成。
I2(g)+H2(g),分离出H2,降低生成物的浓度,使平衡向正方向移动,加速碘的生成。
(4)根据甲醇燃料电池的工作原理图可知,在a电极,失去电子,且H+由左向右迁移,所以a电极是负极,甲醇在负极失电子生成CO2和水,则电极反应式为CH3OH-6e-+H2O = CO2 +6H+。
考点:考查化学反应自发进行的判断,SO2污染的工业治理及甲醇燃料电池。
本题难度:困难
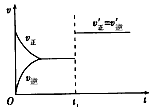
4、选择题 对于可逆反应aA(g)+bB(g) cC(g)+dD(g)在t1时刻增大压强,其速率与时间图像如下
cC(g)+dD(g)在t1时刻增大压强,其速率与时间图像如下
则下列关系式正确的是
[? ]
A.a+b>c+d
B.a+b c+d
c+d
C.a+b=c+d
D.无法判断
参考答案:C
本题解析:
本题难度:一般
5、选择题 对于可逆反应,当确知其平衡向正反应方向移动时,下列说法中正确的是
[? ]
A.生成物的产量一定增大
B.生成物的质量分数一定增大
C.生成物的浓度一定增大
D.反应物的转化率一定增大
参考答案:A
本题解析:
本题难度:一般