1、选择题 COCl2(g)?CO(g)+Cl2(g),△H>0.当反应达到平衡时,下列措施:①升温?②恒压通入惰性气体③增加CO的浓度?④减压?⑤加催化剂,能提高COCl2转化率的是( )
A.①④⑤
B.①②④
C.②③⑤
D.③④⑤
2、填空题 (15分)2013年以来,我国多地频现种种极端天气。二氧化碳、氮氧化物、二氧化硫是导致极端天气的重要因素。
(1)用钌的配合物作催化剂,一定条件下可直接光催化分解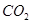 ,发生反应:
,发生反应: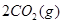 =2CO(g)+
=2CO(g)+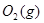 △H>0,该反应的
△H>0,该反应的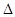 S 0(填“>”“<”或“=”),在低温下,该反应 (填“能”或“不能”)自发进行。
S 0(填“>”“<”或“=”),在低温下,该反应 (填“能”或“不能”)自发进行。
(2)活性炭可用于处理大气污染物NO。在1 L恒容密闭容器中加入0.100 mol NO和2.030 mol固体活性炭(无杂质),生成气体E和气体F。当温度分别在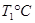 和
和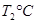 时,测得平衡时各物质的物质的量如下表:
时,测得平衡时各物质的物质的量如下表:
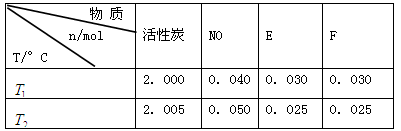
①请结合上表数据,写出NO与活性炭反应的化学方程式: 。
②上述反应在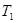 ℃时的平衡常数为
℃时的平衡常数为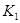 ,在
,在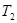 ℃时的平衡常数为
℃时的平衡常数为 。
。
计算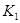 = 。根据上述信息判断,
= 。根据上述信息判断,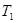 和
和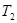 的关系是 。
的关系是 。
a.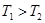 b.
b.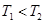 c.无法比较
c.无法比较
③在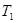 ℃下反应达到平衡后,下列措施不能改变NO的转化率的是____。
℃下反应达到平衡后,下列措施不能改变NO的转化率的是____。
a.增大c(NO) b.增大压强 c.升高温度 d.移去部分F
(3)碘循环工艺不仅能吸收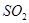 降低环境污染,同时又能制得氢气,具体流程如下:
降低环境污染,同时又能制得氢气,具体流程如下:

①用离子方程式表示反应器中发生的反应 。
②用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出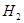 的目的是: 。
的目的是: 。
(4)开发新能源是解决大气污染的有效途径之一。直接甲醇燃料电池(简称DMFC)由于结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注。DMFC工作原理如图所示:
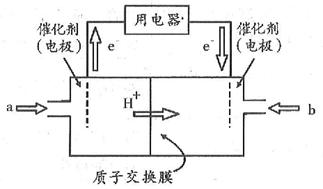
通过a气体的电极是原电池的 极(填“正”或“负”),其电极反应式为 。
3、填空题 向某密闭容器中加入0.15mol/L A、0.05mol/L C和一定量的B三种气体。一定条件下发生反应,各物质浓度随时间变化如下图中甲图所示[t0时c( B)未画出,t1时增大到0.05mol/L]。乙图为 t2时刻后改变反应条件,平衡体系中正、逆反应速率随时间变化的情况。
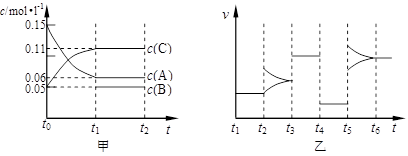
(1)若t4时改变的条件为减小压强,则B的起始物质的量浓度为?mol/L;
该反应的平衡常数表达式为K=?。
(2)若t5时改变的条件是升温,此时v(正) > v(逆),平衡常数K的值将?(选填“增大”、“减小”或“不变”)。
(3)若 t1= 15s,则t0~ t1阶段以C 浓度变化表示的平均反应速率为v(C)=?
mol/L·s。t3时改变的某一反应条件可能是?(选填序号)。
a.使用催化剂? b.增大压强?c.增大反应物浓度? d.降低产物浓度
(4)若A的物质的量减少0.02mol时,容器与外界的热交换总量为a kJ,写出该反应的热化学方程式?。
4、选择题 下列平衡常数中,表示的正反应程度最大的是
A.K=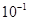
B.K=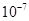
C.K=1
D.K=1010