1、填空题 2016年奥运会将在里约热内卢举行,下图类似奥运五环,表示A、B、C、D、E五种化合物,环交叉部分代表两种化合物含有一种相同元素,且交叉部分所代表的的元素各不相同,五种化合物由五种短周期元素组成,且每种化合物仅由两种元素组成。A是可燃冰的主要成分;B、E分子中所含电子总数均与硅烷(SiH4)分子的电子数相等,B不稳定,具有较强氧化性,能发生自身氧化还原反应,E的相对分子质量为32,具有还原性,且常用作航天器的燃料;D是新型无机非金属材料,它所含两种元素的原子个数之比为3∶4,电子数之比为3∶2。
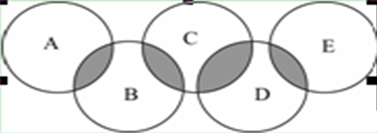
(1) D的化学式为________。
(2)A、B、E中含有一种相同的元素,其名称为________。
(3)B和E反应可生成一种单质和一种常见的液态化合物,写出化学方程式________。
(4)写出C与氢氧化钾溶液反应的离子方程式___________。
参考答案:.(1)Si3N4?(2)氢
(3)N2H4+2H2O=N2↑+H2O
(4)SiO2+2OH-=SiO32-+H2O
本题解析:A是可燃冰的主要成分;说明A是甲烷,B、E分子中所含电子总数均与硅烷(SiH4)分子的电子数相等,说明是18电子,B不稳定,具有较强氧化性,能发生自身氧化还原反应,说明B是H2O2,E的相对分子质量为32,具有还原性,且常用作航天器的燃料,说明是N2H4,D是新型无机非金属材料,它所含两种元素的原子个数之比为3∶4,电子数之比为3∶2,D和E具有相同的元素,可以判断为N,所以结合原子个数比可推知化合价为+4价,再结合原子个数比,可以计算出D是Si3N4,则C是SiO2。
本题难度:一般
2、填空题 各物质有如图所示的转化关系,已知:
(1)化合物E与水反应生成白色浆状物
(2)化合物F是不成盐的氧化物?
(3)组成D的元素在化合物中只能显负一价
据此请填空
(1)化合物F是______
(2)化合物I是______
(3)反应(2)的化学方程式是______
(4)反应(4)的化学方程式是______.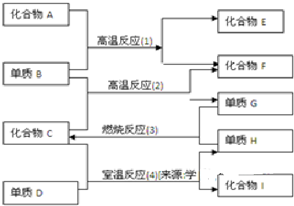
参考答案:反应(1)为高温下的反应,且化合物F为不成盐氧化物,则F为CO,B为C,则A为CaO或氧化铝,化合物E为CaC2或碳化铝;反应(2)为C与水蒸气的反应,所以C为水,G为H2,H为O2,单质D能置换出氧气,其氧化性比氧气的强,则D为F2,所以化合物I为HF,
(1)由上述分析可知,F为CO,故答案为:CO;
(2)由反应(4)的分析可知,I为HF,故答案为:HF;
(3)反应(2)的化学方程式为C+H2O(g)?高温?.?H2+CO,故答案为:C+H2O(g)?高温?.?H2+CO;
(4)反应(4)的化学方程式为2H2O+2F2═4HF+O2,故答案为:2H2O+2F2═4HF+O2.
本题解析:
本题难度:一般
3、推断题 A、B、C、D、E、F六种物质的相互转化关系如图所示(反应条件未标出):
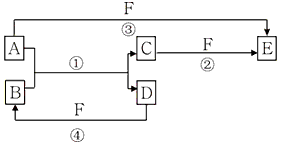
(1)若A、D、F都是短周期非金属元素单质,且A、D常温下为固态单质,所含元素同主族,A、F所含元素同周期,则反应①的化学方程式为_________________________;B固体的晶体类型属于__________晶体。 写出E的结构式_________。
(2)若A是常见的金属单质,常温下D、F是气态单质,反应①和②均在水溶液中进行。用离子方程式解释E的水溶液显酸性原因____________________________,D与F在一定条件下反应生成B的化学方程式为_____________________________。
(3)若A、D为短周期元素单质,且所含元素的原子序数A是D的2倍,所含元素的原子最外层电子数D是A的2倍,③与④两个反应中都有红棕色气体生成(部分产物框图中未给出),则A的原子结构示意图为
_________,D在周期表中位置______________,反应①的化学方程式为_________________________。
参考答案:(1)2C+SiO2=Si+2CO;原子晶体;O=C=O
(2)Fe3++3H2O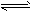 Fe(OH)3+3H+;H2+Cl2
Fe(OH)3+3H+;H2+Cl2 2HCl (3)
2HCl (3)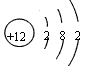 ;第二周期第ⅣA族;2Mg+CO2
;第二周期第ⅣA族;2Mg+CO2 2MgO+C
2MgO+C
本题解析:
本题难度:一般
4、简答题 已知A、B、C、D分别是中学化学中常见的四种不同粒子,它们之间有如下图所示反应关系.
(1)如果A、B、C、D均是10电子粒子,
①请写出A的化学式______
②A和B反应生成C、D的离子反应方程式______
(2)如果A、C均是18电子的粒子,B、D?均是10电子粒子,请写出C的电子式______.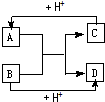
参考答案:(1)如果A、B、C、D均是10电子粒子,结合10电子微粒的结构性质特征判断为:A为NH4+,B为OH-,C为NH3,D为H2O;反应为:NH4++OH-=NH3+H2O;或为:HF+OH-═F-+H2O
①A的化学式为:NH4+?(或HF)
②A和B反应生成C、D的离子反应方程式为:NH4++OH-═NH3↑+H2O?(或HF+OH-═F-+H2O?)
故答案为:NH4+ (或HF);NH4++OH-═NH3↑+H2O (或HF+OH-═F-+H2O )
(2)如果A、C均是18电子的粒子,B、D 均是10电子粒子,结合微粒的性质特征推断:A为H2S,B为OH-,C为HS-或S2-,D为H2O;所以C的电子式为:
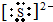
或者
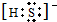
;
故答案为:
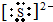
或者
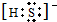
本题解析:
本题难度:一般
5、简答题 (13分) 化合物A相对分子质量为86,碳的质量分数为55.8%,氢为7.0%,其余为氧。A的相关反应如下图所示:
化合物A相对分子质量为86,碳的质量分数为55.8%,氢为7.0%,其余为氧。A的相关反应如下图所示:

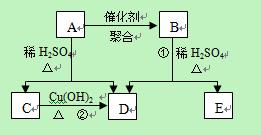

 已知R-CH=CHOH(烯醇)不稳定,很快转化为R-CH2CHO。
已知R-CH=CHOH(烯醇)不稳定,很快转化为R-CH2CHO。

 根据以上信息回答下列问题:
根据以上信息回答下列问题:

 (1)A的分子式为?;
(1)A的分子式为?;
 (2)反应②的化学方程式是?;
(2)反应②的化学方程式是?;

 (3)A的结构简式是?
(3)A的结构简式是?
 ;(4)反应①的化学方程式是?;
;(4)反应①的化学方程式是?;

 (5)A的另一种同分异构体,其分子中所有碳原子在一条直线上,它的结构简式为?。
(5)A的另一种同分异构体,其分子中所有碳原子在一条直线上,它的结构简式为?。
参考答案:(13分)

 (1)C4H6O2?(2分)
(1)C4H6O2?(2分)

 (2)CH3CHO+2Cu(OH)2
(2)CH3CHO+2Cu(OH)2 CH3COOH+Cu2O↓+2H2O?(3分)
CH3COOH+Cu2O↓+2H2O?(3分)

 (3)
(3)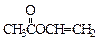 ?(2分)
?(2分)

(4)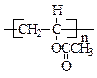 +nH2O
+nH2O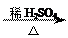
 + nCH3COOH?(3分)
+ nCH3COOH?(3分)

 (5)
(5)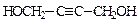 ? (其他合理答案也给分)?(3分)
? (其他合理答案也给分)?(3分)
本题解析:略
本题难度:一般