1、填空题 锂是密度最小的金属,因其有许多优良的性能而被用来制作锂电池。
(1)写出锂在空气中燃烧的化学方程式____,将7.0 g锂投入足量水中,可得到标准状况下的氢气___L。
(2) Li-SO2电池具有输出功率高、低温、性能好等优点,其电解质为LiBr,溶剂是碳酸丙烯酯和乙腈,Li+可在其中移动。电池总反应式为2Li +2SO2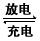 Li2S2O4下列有关该电池的说法正确的是___。
Li2S2O4下列有关该电池的说法正确的是___。
A.该电池总反应为可逆反应
B.充电时阴极反应式为Li++e-=Li
C.放电时Li+向负极移动
D.该电池电解质溶液可换成LiBr水溶液
(3) LiH遇水发生强烈的水解,写出它水解的化学方程式___,所得溶液的pH___ (填“>”、“=”或“<”)7,LiH的电子式为__。
(4)Li2SO4在水溶液中可以发生微弱的水解,试判断下列关系式正确的是___。
A.c(Li+)+c(H+)=c(OH-)+c(SO42-)
B.c(Li+)+c(H+)=c(OH-)+2c(SO42-)
C.2c(Li+) +2c(H+) =2c(OH-)+c( SO42-)
D.c(Li+) =2c(SO42-)
2、选择题 下列说法正确的是
[? ]
A.向0.1mol·L-1 Na2CO3溶液中滴加酚酞,溶液变红色
B.Al3+、NO3-、Cl-、CO32-、Na+可以大量共存于pH=2的溶液中
C.乙醇和乙酸都能溶于水,都是电解质
D.分别于等物质的量的HCl和H2SO4反应时,消耗的NaOH的物质的量相同
3、填空题 甲醇是基础有机化工原料和新型清洁燃料,广泛用于制造各种燃料电池。工业上以甲烷和水蒸气为原料制备甲醇,反应过程如下。
反应Ⅰ:CH4(g)+H2O(g) CO(g)+3H2(g) △H1
CO(g)+3H2(g) △H1
反应Ⅱ:CO(g)+2H2(g) CH3OH(g) △H2
CH3OH(g) △H2
(1)如图是反应1进行过程中的能量变化示意图。根据图象判断,升高温度,反应I的平衡常数将____________ (填“增大”、“减小”或“不变”)。反应I的逆反应的活化能为___________(用含E1、E2的表达式表示)

(2)已知在催化剂和一定压强下,反应?能自发进行。若保持容器容积不变,下列措施可增加该反应中CO转化率的是___________(填字母)。
A.适当降低温度
B.将甲醇从反应体系中分离出来
C.充入He,使体系总压强增大
D.按原比例再充入CO和H2
(3)一种甲醇燃料电池以多孔石墨为电极,一极通入甲醇蒸气,另一极通入氧气,电解质溶液为4L 1 moI/L的KOH溶液。当有3 mol甲醇放电时,电解质溶液中各种离子的浓度由大到小的顺序为_________________
(4)下图甲是一种甲醇燃料电池的结构示意图,甲醇提供质子和电子,电子经外电路到达另一极与氧气反应,电池总反应为2CH3OH+3O2 2CO2+4H2O。
2CO2+4H2O。

①M电极的电极反应式为______________________________。
②以上述电池做电源,用乙图所示装置,在实验室中模拟铝制品表面“钝化”处理的过程中,发现Al电极附近逐渐变浑浊并有气泡逸出,原因是(用离子方程式表示):______________。Al电极应接燃料电池的___________(填“M”或“N”)极。
4、选择题 25℃时,在0.1mol?L-1的下列溶液中,微粒的物质的量浓度关系正确的是( )
A.NH4Cl溶液中:c(NH4+)>c(Cl-)>c(H+)>c(OH-)
B.NaHSO3溶液(呈酸性)中:c(Na+)>c(HSO3-)>c(SO32-)>c(H2SO3)
C.CH3COONa溶液中:c(CH3COOH)+c(H+)=c(OH-)
D.Na2CO3溶液中:2c(Na+)=c(CO32- )+c(HCO3- )+c(H2CO3)
5、选择题 将20 mL 0.1 mol·L-1的氨水与10 mL0.1 mol·L-1的盐酸混合,所得到的溶液中离子浓度的关系错误的是
? [? ]
A. c(NH4+)+c(H+)=c(OH-)+c(Cl-)
B. c(NH4+)+c(NH3·H2O)=2c(Cl-)
C. 2c(OH-)-2c(H+)=c(NH4) -c(NH3·H2O)
D. c(H+) =c(NH3· H2O) +c(OH-)