1、选择题 某温度下气体反应达到化学平衡,平衡常数K=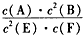 恒容时,若温度适当降低,F的浓度增加。下列说法中正确的是
恒容时,若温度适当降低,F的浓度增加。下列说法中正确的是
[? ]
A.增大c(A)、c(B),K增大
B.降低温度,正反应速率增大
C.该反应的焓变为负值
D.该反应的化学方程式为:2E(g)+F(g)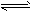 A(g)+2B(g)
A(g)+2B(g)
参考答案:D
本题解析:
本题难度:一般
2、选择 题 反应:L(固)+aG(气)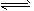 bR(气)达到平衡时,温度和压强对该反应的影响如图所示:图中:压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数。据此判断正确的是
bR(气)达到平衡时,温度和压强对该反应的影响如图所示:图中:压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数。据此判断正确的是
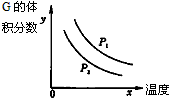
[? ]
A.上述反应是放热反应
B.上述反应是吸热反应
C.△S<0
D.a>b
参考答案:B
本题解析:
本题难度:一般
3、选择题 下列事实不能用勒沙特列原理解释的是( )
A.合成氨反应:N2(g)+3H2(g)

2NH3(g);△H<0,为使氨的产率提高,理论上应采取低温高压的措施
B.对2HI(g)

H2(g)+I2(g)平衡体系增加压强使颜色变深
C.使用催化剂有利于提高SO2与O2生成SO3的效率
D.用排饱和氯化钠溶液的方法来收集氯气
参考答案:A.对N2(g)+3H2(g)

2NH3(g);△H<0,正反应为气体总物质的量减小的反应,且正反应为放热反应,为使氨的产率提高,就要使化学平衡向正反应方向移动,就要降温并且加压,A与勒夏特列原理符合,故A错误;
B.对2HI(g)

H2(g)+I2(g)反应前后气体的总物质的量相等,增大压强,平衡不移动,气体颜色变深是因为体积减小,I2的物质的量浓度增大,不能用勒夏特列原理解释,故B正确;
C.催化剂只能同等程度地改变正逆反应速率,对化学平衡无影响,即不能用勒夏特列原理解释,故C正确;
D.排饱和氯化钠溶液的方法来收集氯气,相当于对Cl2+H2O?H++Cl-+HClO加入NaCl,增大了Cl-的难度,使平衡向逆反应方向移动,降低了氯气的溶解度,即可用勒夏特列原理解释,故D错误;
故选BC.
本题解析:
本题难度:简单
4、填空题 为妥善处理氯甲烷生产企业的副产物CCl4,以减少其对臭氧层的破坏。化学家研究在催化条件下,通过下列反应,使CCl4转化为重要的化工原料氯仿(CHCl3)。CCl4+H2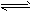 CHCl3+HCl 此反应伴有副反应,会生成CH2Cl2、CH3Cl和CH4等。已知CCl4的沸点为77℃,CHCl3的沸点为61.2℃。在密闭容器中,该反应达到平衡后,测得如下数据(假设不考虑副反应)
CHCl3+HCl 此反应伴有副反应,会生成CH2Cl2、CH3Cl和CH4等。已知CCl4的沸点为77℃,CHCl3的沸点为61.2℃。在密闭容器中,该反应达到平衡后,测得如下数据(假设不考虑副反应)
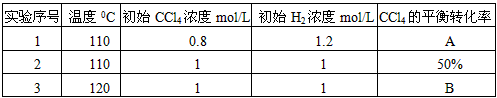
(1)110℃时平衡常数:______________
(2)实验1中,CCl4的转化率A为:______________
(3)实验2中,10小时后达到平衡,H2的平均反应速率为:______________。在此实验的平衡体系中,再加入1.0molCCl4和0.5molHCl,平衡将向______________反应方向移动(填“正”、“逆”或“不移动”);
(4)实验3中,B的值______________
①等于50% ②大于50% ③小于50% ④无法判断
参考答案:(1)1
(2)60%
(3)0.05mol /(L·h);正
(4)④
本题解析:
本题难度:一般
5、填空题 化肥是农业生产最基础而且是最重要的物质投入.工业上利用N2和H2合成氨,其化学方程式为:N2(g)+3H2(g)?2NH3(g)△H<0
(1)下表为不同温度下该反应的平衡常数.由此可推知,表中T1______573K(填“>”、“<”或“=”).
| T/K | T1 | 573 | T2
K
1.00×107
2.45×105
1.88×103
|
(2)将一定量的N2和H2的混合气放入某密闭容器中发生上述反应.
①下列措施中可提高氢气的转化率的有______(填字母).
A.升高温度?B.使用催化剂
C.增大压强?D.循环利用和不断补充氮气
②在一定温度和压强下,将H2和N2按体积比3:1在密闭容器中混合,当该反应达到平衡时,测得平衡混合气中NH3的体积分数为,此时N2的转化率为______.
(3)某厂每天产生600m3含氨废水(NH3?的浓度为153mg?L-1,废氨水密度为1g?cm-3).该厂处理废水的方法:将废水加热得到NH3,使废水中NH3的浓度降为17mg?L-1.再对加热蒸发得到的NH3用一定量空气氧化.发生的主反应如下:
4NH3+5O24NO+6H2O?4NO+3O2+2H2O=4HNO3
副反应为:4NH3+3O2=2N2+6H2O
①该厂每天通过加热蒸发可得到NH3的物质的量是多少?
②若氧化过程中90%?NH3转化为硝酸,10%?NH3发生了副反应,则该厂每天消耗标准状况下的空气多少立方米?(假设废水加热前后的体积和密度近似认为不变,空气中氧气的体积分数20%.)
参考答案:(1)该反应的正反应放热,温度升高平衡向逆反应方向移动,T1时平衡常数大于573K的平衡常数,说明T1<573K,
故答案为:<;
(2)①A.升高温度,平衡向逆反应方向移动,则转化率减小,故A错误;
B.使用催化剂平衡不移动,转化率不变,故B错误;
C.增大压强平衡向正反应方向移动,转化率增大,故C正确;
D.循环利用和不断补充氮气,可使平衡向正反应方向移动,转化率增大,故D正确.
故答案为:CD;
②设起始时H2的物质的量为3mol,N2为1mol,平衡时N2转化了xmol,
? N2(g)+3H2(g)?2NH3(g)
起始:1mol? 3mol? 0
转化:xmol? 3xmol? 2xmol
平衡:(1-x)mol (3-3x)mol 2xmol
则2x1-x+3-3x+2x=17
x=0.25,
此时N2的转化率为0.251×100%=25%,
故答案为:25%;
(3)①n(NH3)=(153-17)mg?L-117g?mol-1×10-3g/mg×600m3×103L/m3=4800mol,
答:该厂每天通过加热蒸发可得到NH3的物质的量是4800mol;
②根据下列发生的主反应:
4NH3+5O2催化剂.高温高压4NO+6H2O,4NO+3O2+2H2O=4HNO3
得主反应中氨气与氧气的物质的量有如下关系式:NH3~2O2
n(O2)主反应=4800?mol×90%×2=8640?mol
根据下列副反应:
4NH3+3O2=2N2+6H2O
n(O2)副反应=4800?mol×10%×3/4=360mol
V(空气)=(8640+360)mol×22.4L/mol×10-3m3/L÷20%=1008m3
答:该厂每天消耗标准状况下的空气1008m3.
本题解析:
本题难度:一般