1、实验题 ⑴在实验室进行的下列实验中,有关仪器的下端必须插入液面以下的是?(填编号)。
①分馏石油时用的温度计?②制备乙烯时用的温度计
③用水吸收溴化氢的导管口?④用碱液吸收多余氯气的导管口
⑤制备H2的简易装置中加入稀硫酸用的长颈漏斗
⑥制备Fe(OH)2时,向FeSO4溶液中滴入NaOH溶液用的胶头滴管
参考答案:②④⑤⑥
本题解析:略
本题难度:简单
2、选择题 下列说法正确的是: (?)
①除去二氧化硫中的少量三氧化硫可用98%的浓硫酸
②盛溴的试剂瓶里加少量水以减少溴的挥发
③钾、钠、白磷都应保存在水中
④做焰色反应实验时所用铂丝,每次用完后用稀硫酸洗涤后再使用
A.①②
B.②④
C.①③
D.①②④
参考答案:A
本题解析:①通过98.3%的浓硫酸,三氧化硫与水反应生成硫酸,反应放出大量的热,且二氧化硫难溶于浓硫酸,可除去二氧化硫中三氧化硫,故正确;②盛溴的试剂瓶里加少量水以减少溴的挥发,正确;③白磷都应保存在水中,错误;④做焰色反应实验时所用铂丝,每次用完后应该用稀盐酸洗涤后再使用,错误;故选A。
本题难度:一般
3、选择题 实验是化学研究的基础。下列关于各实验装置的叙述不正确的是
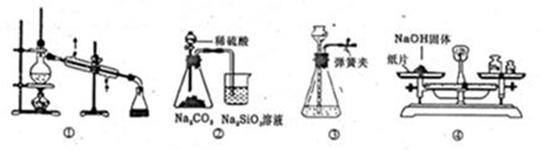
A.装置①可用于乙醇与水的分离
B.装置②所示实验可比较硫、碳、硅三种元素的非金属性强弱
C.装置③,关闭弹簧夹,向长颈漏斗中注水后,长颈漏斗内水面高度保持不变能说明装置不漏气
D.图④装置可用来称量一定质量的NaOH固体
参考答案:D
本题解析:A、乙醇与水互溶,但二者的沸点相差较大,可以用蒸馏的方法分离,A正确;B、稀硫酸与碳酸钠反应生成CO2,CO2通入到硅酸钠溶液中,生成白色沉淀硅酸,所以装置②所示实验可比较硫、碳、硅三种元素的非金属性强弱,B正确;C、装置③,关闭弹簧夹,向长颈漏斗中注水后,长颈漏斗内水面高度保持不变,能说明装置不漏气,C正确;D、氢氧化钠具有吸水性和腐蚀性,用托盘天平称量时,应该非在烧杯中称量,D不正确,答案选D。
本题难度:一般
4、实验题 某铜矿石主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物。实验室以此铜矿石为原料制备CuSO4·5H2O及CaCO3,部分步骤如下:
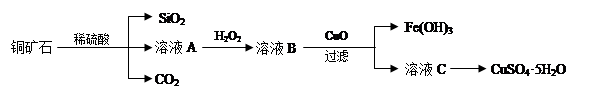
请回答下列问题:
(1)溶液A除含有Cu2+外,还可能含有的金属离子有________(填离子符号);在溶液A中加入H2O2反应的离子方程式是______________。
(2)可用生成的CO2制取优质碳酸钙。制备时,先向氯化钙溶液中通入氨气,再通入CO2。
①实验室通常采用加热氯化铵和氢氧化钙混合物的方法制取氨气。某学习小组选取下图所给部分装置制取并收集纯净的氨气。
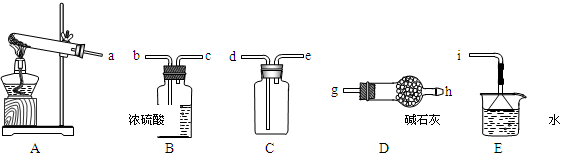
如果按气流方向连接各仪器接口,你认为正确的顺序为a→______、______→______、______→ i。其中与i相连漏斗的作用是______________。
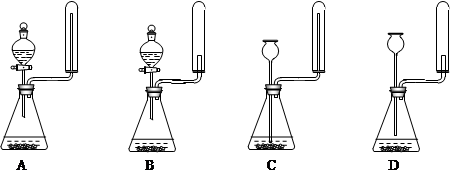
②实验室中还可用固体氢氧化钠和浓氨水制取少量氨气,下列最适合完成该实验的简易装置是
_________(填编号)
(3)测定铜矿石中Cu2(OH)2CO3质量百分含量的方法是:a.将1.25g铜矿石制取的CuSO4·5H2O于锥形瓶中,加入适量水完全溶解;b.向溶液中加入100mL0.25mol/L的氢氧化钠溶液使Cu2+完全沉淀;c.过滤;d.滤液中的氢氧化钠溶液用0.5mol/L盐酸滴定至终点,耗用10mL盐酸。则铜矿石中Cu2(OH)2CO3质量分数为_____________。
参考答案:(1)Fe2+、Fe3+(2分);2Fe2++H2O2 +2H+=2Fe3++2H2O (2分)
(2)①a→g、h→e、d→ i (2分),防止倒吸(1分);②A(2分) (3)88.8%(2分)
本题解析:(1)Cu2(OH)2CO3以及Fe、Si的化合物与稀硫酸反应生成硫酸铜、硫酸亚铁、硫酸铁。二氧化硅与稀硫酸不反应,所以溶液中A中除含有Cu2+外,还可能含有的金属离子有Fe2+、Fe3+;双氧水具有强氧化性,能把亚铁离子氧化生成铁离子,所以在溶液A中加入H2O2反应的离子方程式是2Fe2++H2O2 +2H+=2Fe3++2H2O。
(2)①根据装置图可知,A装置是制备氨气的。由于生成的氨气中含有水蒸气,所以需要干燥,选用碱石灰干燥。氨气的密度小于空气的,且氨气极易溶于水,所以应该用向下排空气法收集,且需要将多余的氨气进行吸收,因此正确的操作顺序是a→g、h→e、d→ i;氨气极易溶于水,因此与i相连的漏斗的作用是防止倒吸。
②用固体氢氧化钠和浓氨水制取少量氨气,因此需要分液漏斗。反应不需要加热,且氨气用向下排空气法收集,所以正确的答案选A。
(3)消耗盐酸的物质的量是0.01L×0.5mol/L=0.005mol,则根据方程式NaOH+HCl=NaCl+H2O可知,与盐酸反应的氢氧化钠是0.005mol。氢氧化钠的物质的量是0.1L×0.25mol/L=0.025mol,则与硫酸铜反应的氢氧化钠是0.025mol-0.005mol=0.020mol。则根据方程式2NaOH+CuSO4=Cu(OH)2↓+Na2SO4可知,硫酸铜的物质的量是0.020mol÷2=0.010mol,所以根据原子守恒可知,铜矿石中Cu2(OH)2CO3的物质的量是0.010mol÷2=0.005mol,所以Cu2(OH)2CO3质量分数为 ×100%=88.8%。
×100%=88.8%。
本题难度:一般
5、选择题 下列说法错误的是
A.为研究某一条件对化学反应的影响,常采用固定其他条件,只让这一条件发生变化的实验方法
B.对比实验是化学实验中常用的方法
C.蓝瓶子实验中亚甲基蓝只发生还原反应
D.蓝瓶子实验中的“振荡周期”的长短反映的是化学反应速率的快慢
参考答案:C
本题解析:蓝瓶子实验中既有亚甲基蓝被葡萄糖还原为亚甲基白的还原反应,又有亚甲基白被O2氧化成亚甲基蓝的氧化反应。
本题难度:简单