1、填空题 (1)环境专家认为可以用铝将水中的NO3-?转化为N2,从而清除污染.该反应中涉及的粒子有:H2O、Al、OH-、Al(OH)3、NO3-、N2,请将各粒子分别填入以下空格(请将整个方程式配平后写在答题纸上).
NO3-+______+______→______+______+______?该反应过程中,被氧化与被还原的元素的物质的量之比为______.
(2)若4Al(s)+3O2(g)=2Al2O3(s)△H=-a?KJ/mol?
Fe2O3(s)+
C(s)=CO2(g)+2Fe?(s)△H=+b?KJ/mol
C(s)+O2(g)=CO2(g)△H=-c?KJ/mol?
写出Al与氧化铁发生铝热反应的热化学方程式:______.
(3)将一定质量的钠铝合金置于水中,合金全部溶解,得到20mL?PH=14的溶液,然后用2mol/L的盐酸滴定,可得到沉淀量与消耗的盐酸体积关系如图:则反应过程中产生氢气的总体积为______L(标准状况).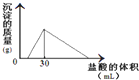
参考答案:(1)反应中NO3-→N2,N元素化合价由+5价降低为0价,共降低10价,Al→Al(OH)3,Al元素化合价由0价升高为+3价,共升高3价,根据电荷守恒可知OH-是生成物,由H元素守恒可知H2O是反应物,化合价升降最小公倍数为30,故N2系数为3,Al系数为10,根据N元素守恒可知NO3-系数为6,根据Al元素守恒可知Al(OH)3系数为10,电荷守恒可知OH-系数为6,根据H元素守恒可知H2O系数为,配平后离子方程式为6NO3-+10Al+18H2O=10Al(OH)3+3N2+6OH-.由方程式可知被氧化与被还原的元素的物质的量之比10:6=5:3.
故答案为:10Al、18H2O=10Al(OH)3、3N2、6OH-;5:3.
(2)已知:①4Al(s)+3O2(g)=2Al2O3(s)△H=-a?KJ/mol?
②Fe2O3(s)+32C(s)=32CO2(g)+2Fe?(s)△H=+b?KJ/mol
③C(s)+O2(g)=CO2(g)△H=-c?KJ/mol?
由盖斯定律可知,②-③×32+①×12得:2Al(s)+Fe2O3(s)=2Fe(s)+Al2O3(s)△H=-(12a-b-32c)KJ/mol.
故答案为:2Al(s)+Fe2O3(s)=2Fe(s)+Al2O3(s)△H=-(12a-b-32c)KJ/mol.
(3)由图可知加入盐酸不与立刻生成沉淀,说明盐酸先中和氢氧化钠,故合金全部溶解所得溶液为氢氧化钠与偏铝酸钠混合溶液,溶液中n(Na+)=n(OH-)+n(AlO2-),当加入盐酸30mL时,沉淀量最大,此时溶液为氯化钠溶液,根据氯元素守恒有n(NaCl)=n(HCl)=0.03L×2mol/L=0.06mol,根据钠元素守恒有n(NaCl)=n(Na)=n(Na+)=0.06mol,PH=14的溶液中c(OH-)=1mol/L,n(OH-)=0.02L×1mol/L=0.02mol,所以n(AlO2-)=0.06mol-0.02mol=0.04mol,所以
n(Al)=n(AlO2-)=0.04mol,根据电子转移守恒n(H2)×2=n(Na)×1+n(Al)×3,2n(H2)=0.06mol+0.04mol×3=0.18mol,故n(H2)=0.09mol,V(H2)=0.09mol×22.4L/mol=2.016L.
故答案为:2.016.
本题解析:
本题难度:一般
2、选择题 在下列反应中,水既不作氧化剂,又不作还原剂的是( )
A.2Na+2H2O=2NaOH+H2↑
B.Na2O+H2O=2NaOH
C.2F2+2H2O=4HF+O2
D.C+H2O?
CO+H2
参考答案:A.Na+H2O的反应中,Na元素的化合价升高,水中H元素的化合价降低,则水作氧化剂,故A错误;
B.该反应中,各元素的化合价都不变,所以不是氧化还原反应,则水既不作氧化剂,又不作还原剂的,故B正确;
C.F2+H2O的反应中,F元素的化合价降低,水中O元素的化合价升高,则水作还原剂,故C错误;
D.C+H2O的反应中,H元素的化合价降低,则水作氧化剂,故D错误;
故选B.
本题解析:
本题难度:简单
3、选择题 LiAlH4(
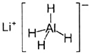
)、LiH是金属储氢材料,又是有机合成中的常用试剂,遇水均能剧烈反应释放出H2,LiAlH4在125℃分解为LiH、H2和Al.下列说法不正确的是( )
A.LiH与D2O反应,所得氢气的摩尔质量为4g?mol-1
B.1?mol?LiAlH4在125℃完全分解,转移3?mol?电子
C.标准状况下,1?mol?LiAlH4跟足量水反应可生成89.6L氢气
D.LiAlH4与乙醛反应可生成乙醇,其中LiAlH4作还原剂
参考答案:A.由LiH+D2O═LiOD+HD↑可知,所得氢气的摩尔质量为3g?mol-1,故A错误;
B.LiAlH4在125℃分解为LiH、H2和Al,Al由+3价降低为0,则1mol?LiAlH4在125℃完全分解,转移3?mol电子,故B正确;
C.由LiAlH4+4H20═LiOH+Al(OH)3↓+4H2↑可知,标准状况下,1mol?LiAlH4跟足量水反应可生成4mol×22.4L/mol=89.6L氢气,故C正确;
D.LiAlH4与乙醛反应可生成乙醇,乙醛被还原,LiAlH4作还原剂,故D正确;
故选A.
本题解析:
本题难度:一般
4、选择题 P单质在反应4P+3KOH+3H2O═3KH2PO2+PH3中的变化是( )
A.被氧化
B.被还原
C.既被氧化又被还原
D.既未被氧化又未被还原
参考答案:4P+3KOH+3H2O═3KH2PO2+PH3中,
P元素的化合价由0升高到+1价,
P元素的化合价由0降低到-3价,
则P既被氧化又被还原,
故选C.
本题解析:
本题难度:简单
5、选择题 ClO2是一种消毒杀菌效率高、二次污染小的水处理剂.实验室可以通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4
2ClO2 ↑+K2SO4+2CO2↑+2H2O,下列说法正确的是( )
A.KClO3在反应中失去电子
B.H2C2O4在反应中是还原剂
C.ClO2是氧化产物
D.1?mol?KClO3参加反应有2?mol电子转移
参考答案:A.该反应中,氯酸钾中氯元素得电子化合价降低,所以氯酸钾是氧化剂,故A错误;
B.H2C2O4在反应中失电子化合价升高,所以H2C2O4是还原剂,故B正确;
C.氯酸钾是氧化剂,所以ClO2是还原产物,故C错误;
D.2molKClO3参加反应有2?mol电子转移,所以1molKClO3参加反应有1?mol电子转移,故D错误;
故选B.
本题解析:
本题难度:简单