1、选择题 可以将反应Zn+Br2 = ZnBr2设计成蓄电池,下列4个电极反应: ① Br2+2e- = 2Br- ② 2Br--2e- = Br2 ③ Zn-2e- = Zn2+ ④ Zn2++2e- = Zn,其中表示充电时的阳极反应和放电时的负极反应的分别是
[? ]
A.②和③
B.②和①
C.③和①
D.④和①
参考答案:A
本题解析:
本题难度:一般
2、选择题 下列说法正确的是
A.强电解质溶液的导电性一定比弱电解质溶液的导电性强
B.食盐溶液能导电,所以它是电解质
C.SO3的水溶液可以导电,但它是不是电解质
D.NaHso4无论是在水溶液里还是在熔融状态都可以电离去出Na+、H+和so42-
参考答案:C
本题解析:略
本题难度:简单
3、选择题 用铂电极电解下表中各组物质的稀溶液(如图)一段时间后,甲、乙两池中溶液的pH均碱小,且在①和④两极的电极产物的物质的量之比为1:2的是( )
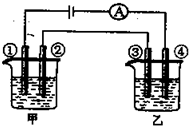
| A | B | C | D
甲
KOH
H2SO4
Na2SO4
CuSO4
乙
CuSO4
AgNO3
HCl
HNO3
|
A.A
B.B
C.C
D.D
参考答案:A、甲池中,电解氢氧化钾的实质是电解水,碱性增强,pH增大,故A错误;
B、甲池中,①是阳极,发生电极反应:4OH-=4e-+O2+2H2O,电解硫酸的实质是电解水,酸性增强,pH减小,乙池中,④电极是阴极,发生电极反应4Ag++4e-=4Ag,在转移电子一样的情况下,①电极产生的氧气和④电极产生的金属银物质的量之比是1:4,故B错误;
C、甲池中,①是阳极,发生电极反应:4OH-=4e-+O2+2H2O,电解硫酸钠的实质是电解水,pH不变,故C错误;
D、甲池中,①是阳极,发生电极反应:4OH-=4e-+O2+2H2O,电解硫酸铜的过程生成硫酸,溶液酸性增强,pH减小,乙池中,④电极是阴极,发生电极反应4H++4e-=2H2,在转移电子一样的情况下,①电极产生的氧气和④电极产生的氢气物质的量之比是1:2,故D正确.
故选D.
本题解析:
本题难度:简单
4、填空题 某化学研究小组以铜为电极电解饱和食盐水,探究过程如下:
【实验1】:如图装置,电源接通后,与电池负极相连的铜丝上有大量气泡产生;与电池正极相连的铜丝由粗变细.电解开始
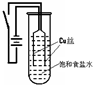
30s内,阳极附近出现白色浑浊,然后开始出现橙黄色浑浊,此时测定溶液的pH约为10.随着沉淀量的逐渐增加,橙黄色沉淀慢慢聚集在试管底部,溶液始终未出现蓝色.
【实验2】:将实验1中试管底部的橙黄色沉淀取出,分装在两支小试管中,以后的操作和现象如下:
| 序号 | 操作 | 现象
①
滴入稀硝酸溶液
沉淀溶解,有无色气泡产生,最终得到蓝色溶液.
②
滴入稀硫酸溶液
橙黄色沉淀转变为紫红色不溶物,溶液呈现蓝色
|
阅读资料:常见铜的化合物颜色如下:
| 物质 | 颜色 | 物质 | 颜色
氯化铜
固体呈棕色,浓溶液呈绿色,稀溶液呈蓝色
氢氧化亚铜(不稳定)
橙黄色
碱式氯化铜
绿色
氢氧化铜
蓝色
氧化亚铜
砖红色或橙黄色
氯化亚铜
白色
|
请回答下列问题:(1)铜的常见正化合价为______,最终试管底部橙黄色沉淀的化学式______;
(2)阳极上发生的反应为:______;
(3)写出实验2中①、②的离子方程式①______②______.
参考答案:(1)氯化铜中铜的化合价为+2价,氧化亚铜中铜的化合价为+1价,所以铜的常见正化合价为+1、+2;根据常见铜的化合物颜色判断,试管底部橙黄色沉淀的物质是Cu2O.
故答案为:+1、+2; Cu2O.
(2)电解时,铜作阳极,阳极上铜失电子生成亚铜离子进入溶液,亚铜离子和氯离子生成氯化亚铜白色沉淀,所以电极反应式为2Cu+2Cl--2e-=2CuCl↓.
故答案为:2Cu+2Cl--2e-=2CuCl↓.
(3)①根据实验现象及硝酸和氧化亚铜的性质、及常见铜的化合物颜色判断,生成物是一氧化氮、硝酸铜和水,所以离子方程式为3Cu2O+2H++2NO3-=6Cu2++2NO↑+7H2O
②根据实验现象及常见铜的化合物颜色,生成物是铜、硫酸铜和水,所以离子方程式为Cu2O+2H+=Cu+Cu2++H2O.
故答案为:3Cu2O+2H++2NO3-=6Cu2++2NO↑+7H2O;Cu2O+2H+=Cu+Cu2++H2O.
本题解析:
本题难度:一般
5、选择题 某同学按如图所示装置进行实验,R、M为常见金属,它们的硫酸盐可溶于水。当K闭合时,在交换膜处
SO42-从右向左移动。下列分析正确的是
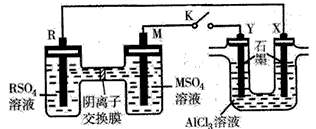
[? ]
A.溶液中c(R2+)减小
B.M极的电极反应式为M-2e-==M2+
C.Y电极上有H2产生,发生还原反应
D.反应初期,X电极周围出现白色胶状沉淀
参考答案:D
本题解析:
本题难度:一般