1、选择题 将铁粉和铜粉的均匀混合物,平均分成四等分,分别加入同浓度的稀硝酸,充分反应,在标准状况下生成NO的体积和剩余金属的质量如下表(设硝酸的还原产物只有NO):
编 号
| ①
| ②
| ③
| ④
|
稀硝酸体积/mL
| 100 mL
| 200 mL
| 300 mL
| 400 mL
|
剩余金属/g
| 18.0 g
| 9.6 g
| 0
| 0
|
NO体积/L
| 2.24 L
| 4.48 L
| 6.72 L
| V
|
?
经化学定量分析,下列推断正确的是( )
A.①中溶解了5.6g Fe? B.硝酸的浓度为4mol/L
C.②中溶解了9.6g Cu? D.④中V=6.72 L
参考答案:B
本题解析:A、铁的金属性强于铜,所以稀硝酸首先氧化单质铁,然后再氧化单质铜。实验①②中金属均过量,所以铁的氧化产物是硝酸亚铁。实验②比实验①多溶解了18.0g-9.6g=8.4g金属,而还原产物NO多了4.48L-2.24L=2.24L,物质的量是0.1mol,转移0.1mol×(5-2)=0.3mol。所以8.4g金属也转移0.3mol电子,因此金属的相对原子质量=8.4÷(0.3÷2)=56,这说明溶解的金属恰好是铁,因此实验①中也恰好溶解了8.4g铁,A不正确;B、实验①中生成硝酸亚铁0.15mol,NO是0.1mol,实验根据氮原子守恒可知,参加反应的硝酸是0.15mol×2+0.1mol=0.4mol,所以稀硝酸的浓度是0.4mol÷0.1L=4mol/L、B正确;C、②中溶解了8.4g×2=16.8g铁,C不正确;D、实验③比实验②多溶解了9.6g金属,多生成的NO是6.72L-4.48L=2.24L,物质的量是0.1mol,转移0.1mol×(5-2)=0.3mol。如果9.6g金属恰好是铜,则转移电子是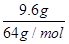 ×2=0.3mol,这说明9.6g金属就是铜。由于溶液中含有Fe2+,所以继续加入硝酸或继续产生NO,④中V>6.72 L所以选项D不正确,答案选B。
×2=0.3mol,这说明9.6g金属就是铜。由于溶液中含有Fe2+,所以继续加入硝酸或继续产生NO,④中V>6.72 L所以选项D不正确,答案选B。
本题难度:一般
2、选择题 如果ag某气体中含有的分子数为b,则cg 该气体在标准状况下的体积是(式中NA为阿伏加德罗常数的值)
[? ]
A.(22.4 bc/aNA)L
B.(22.4 ab/cNA)L
C.(22.4 ac/bNA)L
D.(22.4 b/acNA)L
参考答案:A
本题解析:
本题难度:一般
3、选择题 某同学在配制500mL 0.5mol/LNaOH溶液的实验过程中,除用到玻璃棒、烧杯、500 mL容量瓶、量筒、胶头滴管、试剂瓶之外,还需要的主要仪器有
[? ]
A.天平
B.温度计
C.蒸发皿
D.酒精灯
参考答案:A
本题解析:
本题难度:简单
4、选择题 用NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
A.1 mol·L-1 NaCl溶液中含有NA个Na+
B.25 ℃,101 kPa,64 g SO2中含有的原子数为3NA
C.在常温常压下,22.4 L Cl2含有的分子数为 NA
D.标准状况下,11.2 L CCl4含有的分子数为0.5NA