1、简答题 取一定质量的Al粉和一定质量的某种铁的氧化物混合进行铝热反应,两者恰好完全反应.若在反应后混合物中加入足量的稀硫酸,产生H2的体积为V1L,另取相同质量的Al粉,加入足量稀硫酸,产生H2的体积为V2L(V1,V2均在标况下测定),则V2:V1=4:3.另取相同质量的铁的氧化物,加入盐酸溶解,消耗盐酸的物质的量为2.4mol.则
(1)写出铝热反应方程式(以FexOy表示铁的氧化物)______.
(2)此铁的氧化物的化学式为______.
(3)铝粉的物质的量为______.
参考答案:(1)因铝热反应是铝与金属氧化物反应生成氧化铝和金属,所以2yAl+3FexOy??高温?.?3xFe+yAl2O3;
(2)因两者恰好完全反应后,反应后混合物的成分为Fe和Al2O3,加入加入足量的稀硫酸后,铁能与稀硫酸反应:
? Fe+2HCl=FeCl2+H2↑?
?1mol? 22.4L
? n(?Fe)?V1L
?解得? n(?Fe)=V122.4mol?
另取相同质量的Al粉,加入足量稀硫酸,Al粉能与稀硫酸反应:
? 2Al+6HCl=2AlCl3+3H2↑
?2mol? 67.2L
?n(Al)?V2L?
? 解得:n(Al)=V233.6mol?
? 根据2yAl+3FexOy??高温?.?? 3xFe+yAl2O3
? ?2y?3x?
? V233.6? V122.4
?得yx=V2V1=43
?所以铁的氧化物的化学式为Fe3O4;?
?(3)因Fe3O4能与盐酸反应:Fe3O4 +8HCl=2FeCl3+FeCl2+4H2O
?0.3mol? 2.4mol?
? 根据? 8Al+3Fe3O4?高温?.?? 9Fe+4Al2O3
?0.8mol?0.3mol?
故答案为:(1)2yAl+3FexOy??高温?.?3xFe+yAl2O3?
(2)Fe3O4?
(3)0.8mol
本题解析:
本题难度:一般
2、选择题 下列叙述中,正确的是:?
A.失电子难的原子,获得电子的能力一定强
B.得电子越多的氧化剂,其氧化性就越强
C.在氧化还原反应中,肯定有一种元素被氧化,另一种元素被还原
D.化学反应的实质是原子的重新组合
参考答案:D
本题解析:略
本题难度:简单
3、简答题 把19.2g?的Cu放入足量的稀硝酸中,微热至Cu完全反应.已知:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O求:
(1)参加反应的硝酸的物质的量;
(2)被还原的硝酸的质量;
(3)生成的NO在标准状况下的体积.
参考答案:19.2g?的Cu的物质的量为19.2g64g/mol=0.3mol,
(1)设参加反应的硝酸的物质的量为x
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
3mol ?8mol?
0.3mol ?x
x=0.8mol,
答:参加反应的硝酸的物质的量为0.8mol.
(2)由方程式可以看出,硝酸没有全部被还原,当有8mol硝酸反应时,有2mol被还原,
则0.8mol硝酸参加反应,被还原的硝酸的物质的量为0.2mol,
质量为:0.2mol×63g/mol=12.6g.
(3)设产生的NO在标准状况下的体积为V,则
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
3mol?44.8L
0.3mol? V
V=4.48L,
答:产生的NO在标准状况下的体积为4.48L.
本题解析:
本题难度:一般
4、选择题 根据以下反应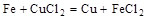 ,?
,?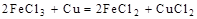 , 判断:
, 判断: 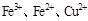 氧化性强弱的顺序是?
氧化性强弱的顺序是?
A.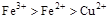
B.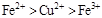
C.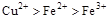
D.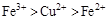
参考答案:D
本题解析:该题利用氧化性的强弱顺序:氧化剂>氧化产物;
分析第一个反应:CuCl2是氧化剂(铜由+2价降低到0价,被还原),FeCl2是氧化产物(铁由0价升高到+2价,被氧化);分析第二个反应:FeCl3是氧化剂(铁由+3价降低到+2价,被还原),CuCl2是氧化产物(铜由0价升高到+2价,被氧化);故选D
本题难度:一般
5、选择题 下列有关化学用语表述正确的是
A.羟甲基(-CH2OH)和甲氧基(CH3O-)电子数不相等
B.S2-的结构示意图: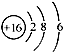
C.质子数为53,中子数为78的碘原子: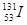
D.苯甲醛: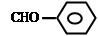
参考答案:C
本题解析:A、两种基团原子数目和种类相同,电子数相同,错误;B、硫离子得到电子最外层电子数为8个,错误;C、正确;D、醛基书写错误,错误。
本题难度:一般