1、选择题 已知反应:
①101kPa时,2C(s)+O2(g)=2CO(g);△H=-221 kJ/mol
②稀溶液中,H+(aq)+OH-(aq)=H2O(1);△H=-57.3 kJ/mol
③红磷的化学式为P,白磷的化学式为P4,已知
P4(s)+5O2(g)=P4O10(s) △H=-3093.2 kJ/mol
4P(s)+5O2(g)=P4O10(s) △H=-2954.0 kJ/mol
下列结论正确的是
[? ]
A.由于红磷转化为白磷 91eXaM.org是放热反应,等质量的红磷能量比白磷低
B.稀硫酸与稀NaOH溶液反应的中和热△H=57.3 kJ/mol
C.碳的燃烧热大于-110.5 kJ/mol
D.稀醋酸与稀NaOH溶液反应生成1 mol水,△H大于-57.3 kJ/mol
参考答案:D
本题解析:
本题难度:一般
2、选择题 25℃,101 kPa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3 kJ/mol,辛烷的燃烧热为5518 kJ/mol.下列热化学方程式书写正确的是
[? ]
A.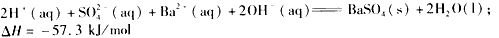
B.
C.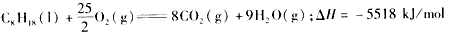
D.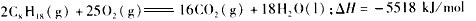
参考答案:B
本题解析:
本题难度:简单
3、选择题 常温下,用 0.1000 mol·L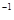 NaOH溶液滴定 20.00mL0.1000 mol·L
NaOH溶液滴定 20.00mL0.1000 mol·L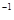
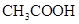 溶液所得滴定曲线如下图。下列说法正确的是
溶液所得滴定曲线如下图。下列说法正确的是

A.点①所示溶液中: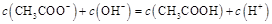
B.点②所示溶液中: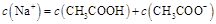
C.点③所示溶液中: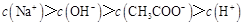
D.滴定过程中可能出现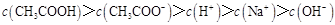
参考答案:D
本题解析:点①所示溶液中,醋酸是过量的,溶液显酸性。溶液是由等量的醋酸和醋酸钠混合而成的。由于醋酸的电离程度大于醋酸钠的水解程度,所以 。根据电荷守恒可判断
。根据电荷守恒可判断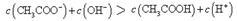 ,选项A是不正确的。点②所示溶液显中性,此时醋酸是过量的,所以
,选项A是不正确的。点②所示溶液显中性,此时醋酸是过量的,所以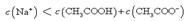 ,B不正确。点③所示溶液中,醋酸和氢氧化钠恰好反应,生成的盐水解显碱性,所以
,B不正确。点③所示溶液中,醋酸和氢氧化钠恰好反应,生成的盐水解显碱性,所以 ,C不正确。当加入的氢氧化钠很少时,D是有可能正确的,所以答案是D。
,C不正确。当加入的氢氧化钠很少时,D是有可能正确的,所以答案是D。
本题难度:一般
4、计算题 (6分)常温下,将0.05mol/L盐酸溶液和未知浓度的NaOH溶液以1:2的体积比混合,所得溶液的pH=12。用上述NaOH溶液13 ml和pH=3的某一元弱酸HA溶液20ml恰好完全反应生成NaA。试求:
(1)NaOH溶液的物质的量浓度
(2)此一元弱酸的物质的量浓度
(3)求此条件下该一元弱酸的电离平衡常数
参考答案:(6分)(1)c(NaOH)=0.04mol/L? (2)c(HA)=0.026mol/L? (3)k=4.0×10-5
本题解析:(1)两溶液混合后呈碱性,说明碱过量,设两溶液的体积分别为:V、2V
则: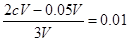 ,得c(NaOH)=0.04mol/L
,得c(NaOH)=0.04mol/L
(2)NaOH~HA,即:0.04×13=c(HA)×20,推出:c(HA)=0.026mol/L
(3)代入电离平衡常数公式:
K=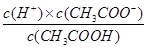 ?=
?=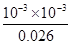 =4.0×10-5
=4.0×10-5
本题难度:一般
5、选择题 已知:
2H2(g)+O2(g)===2H2O(l)?ΔH=-571.6 kJ·mol-1
2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l)?ΔH=-1452 kJ·mol-1
H+(aq)+OH-(aq)===H2O(l)?ΔH=-57.3 kJ·mol-1
下列说法正确的是
A.H2(g)的燃烧热为571.6 kJ·mol-1
B.同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多
C.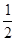 H2SO4(aq)+
H2SO4(aq)+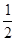 Ba(OH)2(aq)===
Ba(OH)2(aq)===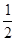 BaSO4(s)+H2O(l)ΔH=-57.3 kJ·mol-1
BaSO4(s)+H2O(l)ΔH=-57.3 kJ·mol-1
D.3H2(g)+CO2(g)=CH3OH(l)+H2O(l)ΔH=+135.9 kJ·mol-1
参考答案:B
本题解析:A、氢气的计量数不是1,所以不是其燃烧热,错误;C、必须是只生成可溶性的盐和水,错误;D、其焓变不是ΔH=+135.9 kJ·mol-1,错误。
本题难度:一般