1、选择题 下列叙述正确的是
A.将pH=2的盐酸和pH=2的醋酸等体积混合,混合后溶液的pH=2
B.HA-比HB-更难电离,则NaHA溶液的pH一定比NaHB溶液的大
C.在饱和氨水中加入同浓度的氨水,平衡正向移动
D.某温度下,Ba(OH)2溶液中,Kw=10-12,pH=8的该溶液中加入等体积pH=4的盐酸,混合溶液的pH=7
参考答案:A
本题解析:A、两种溶液等体积混合后醋酸分子和醋酸根的浓度都下降为原来的一半,但两者的比值不变,混合后氢离子浓度也不变,所以QC等于Ka,平衡不移动,混合后溶液的pH等于2,正确;B、若NaHA溶液和NaHB溶液都是碱性溶液,则需要考虑H2A和H2B的酸性才能确定溶液pH的关系,错误;C、平衡不移动,错误;D、恰好中和得到中性溶液,pH= 6,错误。
本题难度:一般
2、选择题 已知某温度下,0.l mol·L-1NaHB溶液中,C(H+)>c(OH-),则下列各关系式一定正确的是
A.c(Na+)=c(HB-)+2c(B2-)+c(OH-)
B.溶液的pH="1"
C.c(Na+)="0.l" mol·L-1≥c(B2-)
D.C(H+).c(OH-)=10-14
参考答案:C
本题解析:
A.根据题意,NaHB是强电解质,溶液呈酸性,如果存在HB-,则 HB-的电离程度大于水解程度,即 NaHB溶液中含有的离子是(Na+)、(H+)、c(HB-)、c(B2-)、c(OH-),根据电荷守恒得:c(Na+)+c(H+)=c(HB-)+2c(B2-)+c(OH-),故A错误;
B.NaHB是强电解质,溶液呈酸性,可能有两种情况,即HB-能够完全电离,也可能部分电离.当HB-完全电离时,0.1mol/L的NaHB的pH=1,当HB-部分电离时,0.1mol/L的NaHB的pH>1.故B错误;
C.NaHB是强电解质,说明0.1mol/L的NaHB的溶液中c(Na+)=0.1mol/L.根据B项的分析,当HB-完全电离时,0.1mol/L的NaHB的c(B2-)=0.1mol/L,当HB-部分电离时,c(B2-)<0.1mol/L.因此,c(Na+)=0.1mol/L≥c(B2-),故C正确;
D.在0.1mol/L的NaHB溶液中,无法求解氢离子的浓度,因而无法确定c(H+)-c(OH-)=10-14,但是可以知道c(H+)×c(OH-)=10-14,故D错误;
故选C.
本题难度:简单
3、选择题 把1 mL pH=5的盐酸稀释至1 L,此时溶液的pH是(?)
A.6—7之间
B.7—8之间
C.8
D.7
参考答案:A
本题解析:pH=5的盐酸溶液c(H+)=10-5 mol·L-1,稀释1000倍后,盐酸电离出的c(H+),变为10-8 mol·L-1,这时要考虑水的电离c(H+)接近10-7 mol·L-1,故溶液中总的c(H+)略大于10-7 mol·L-1,pH接近且略小于7,A选项正确。
本题难度:简单
4、实验题 (12分)某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的酸度(酸度单位:g/100ml),现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定。下表是4种常见指示剂的变色范围:
指示剂
| 石蕊
| 甲基橙
| 甲基红
| 酚酞
|
变色范围(PH)
| 5.0-8.0
| 3.1-4.4
| 4.4-6.2
| 8.2-10.0
|
(1)该实验应选用?作指示剂,向锥形瓶中移取一定体积的白醋所用的仪器是?。
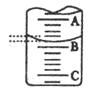
(2)下图表示50ml滴定管中液面的位置,若A与C刻度间相差1ml,A处的刻度为25,滴定管中液面读数为?ml。此时滴定管中液体的体积?。
(3)为了减小实验误差,该同学一共进行了三次实验,假设每次所取白醋体积均为Vml,NaOH标准液浓度为C mol/L,三次实验结果记录如下:
实验次数
| 第一次
| 第二次
| 第三次
|
消耗NaOH溶液体积/ml
| 26.02
| 25.32
| 25.28
|
从上表可以看出,第一次实验中记录消耗NaOH溶液体积明显多于后两次,其原因可能
是?
A.实验结束时俯视刻度线读取滴定终点时NaOH溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.盛装标准液的滴定管装液前用蒸馏水润洗过,未用标准液润洗
D.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗
E.滴定NaOH溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定
(4)根据所给数据,写出计算该白醋中总酸度的表达式(可以不必化简):?
(酸度:每100ml溶液中含有溶质酸的质量,单位:g/100ml)
参考答案:(1)酚酞,酸式滴定管(或移液管)(2)25.40;大于24.60mL(3)BCD
(4)
本题解析:醋酸钠显碱性用酚酞,第一次实验中记录消耗NaOH溶液体积明显多于后两次,其原因可能滴定前滴定管尖嘴有气泡,滴定结束无气泡V1偏小,盛装标准液的滴定管装液前用蒸馏水润洗过,未用标准液润洗,标液浓度偏低,要的体积多些。.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗,锥形瓶不需要润洗,洗了酸液多了要的碱液多了。
本题难度:一般
5、选择题 将30 mL 0.5 mol·L―1的NaCl溶液加水稀释到500 mL,稀释后溶液中NaCl的物质的量浓度为
A.0.3 mol·L―1
B.0.03 mol·L―1
C.0.05 mol·L―1
D.0.04 mol·L―1
参考答案:B
本题解析:令稀释后溶液中NaCl的物质量浓度为c,则:
30mL×10-3L×0.5mol/L=500mL×10-3L×c
解得c=0.03mol/L.
故选B。
点评:本题考查物质的量浓度有关计算,难度较小,关键清楚稀释定律,溶液稀释前后溶质的物质的量不变。
本题难度:简单