1、选择题 中央电视台报道,一种名叫“排毒基强离子排毒仪”的产品正在市场热销。向排毒盆内倒入了纯净的温水,双脚放入盆中,启动电源开关,加入了适量精盐。过一段时间,盆中开始出现绿色、红褐色的絮状物。下列说法正确的是 (? )
A.此“排毒基强离子排毒仪”一定是用惰性电极制成的
B.绿色、红褐色的絮状物是氢氧化亚铁、氢氧化铁形成的混合物
C.绿色、红褐色的絮状物就是从脚底排出的体内毒素
D.加一些精盐的主要目的只是起到消炎杀菌的作用
参考答案:B
本题解析:该“排毒基强离子排毒仪”在工作过程中加入了精盐,说明了其原理与电解食盐水基本相同,由此可以知道该排毒仪为假冒商品;加入适量的精盐是为了产了氢氧根,所以D错误;此“排毒基强离子排毒仪”不一定是用惰性电极制成的,其阳极应该为惰性电极,但是阴极可以不为惰性电极,故A错误;绿色、红褐色的絮状物是氢氧化亚铁、氢氧化铁形成的混合物,故B正确,绿色、红褐色的絮状物不是从脚底排出的体内毒素,故C错误。
点评:本题结合市场上的假冒商品巧妙了考查了电解食盐水的知识,该题比较创新,有利于培养学生学以致用的思维,本题难度适中。
本题难度:简单
2、选择题 用Pt电极电解含有0.1 mol Cu2+和0.1 mol X3+的溶液,阴极析出固体物质的质量m(g)与溶液中通过电子的物质的量n(mol)的关系如图所示。则离子的氧化能力由大到小排列正确的是
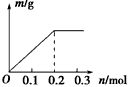
[? ]
A.Cu2+>X3+>H+
B.H+>X3+>Cu2+
C.X3+>H+>Cu2+
D.Cu2+>H+>X3+
参考答案:D
本题解析:
本题难度:一般
3、选择题 以Pt为电极,电解含有0.10mol M+和0.10mol N3+ (M+、N3+均为金属阳离子)的溶液,阴极析出金属单质或气体的总物质的量(y)与导线中通过电子的物质的量(x)的关系如下图。对离子氧化能力的强弱判断正确的是(选项中H+为氢离子)
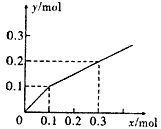
[? ]
A.M+ > H+ > N3+
B.M+ >N3+ > H+
C.N3+ >H+ > M+
D.条件不足,无法确定
参考答案:A
本题解析:
本题难度:一般
4、填空题 (1)有人研究证明:使用氯气作自来水消毒剂,氯气会与水中有机物反应,生成如CHCl3等物质,这些物质可能是潜在的致癌致畸物质。目前人们已研发多种饮用水的新型消毒剂。下列物质不能作自来水消毒剂的是_____________(填序号)。
A.硫酸铜 B.二氧化氯 C.臭氧 D.硫酸亚铁
(2)高铁(VI)酸盐(如Na2FeO4)是新一代水处理剂。其制备方法有:次氯酸盐氧化法(湿法)和高温过氧化物法(干法)等。湿法是在碱性溶液中用次氯酸盐氧化铁(III)盐,写出该法的离子方程式:
___________________________。
(3)用高铁(VI)酸盐设计的高铁(VI)电池是一种新型可充电电池,电解质溶液为KOH溶液,放电时的总反应:3Zn+2K2FeO4+8H2O→3Zn(OH)2+2Fe(OH)3+4KOH
①写出正极发生的电极反应式:______________________。
②用高铁(VI)电池作电源,以Fe作阳极,以Cu作阴极,对足量KOH溶液进行电解,当电池中有
0.2molK2FeO4反应时,则在电解池中生成H2 __________L(标准状况)。
③下表列出了某厂排放的含锌废水中的含量及国家环保标准值的有关数据

该厂只用调节pH处理废水,当调整为pH=7时,此时废水中Zn2+的浓度为__________mg/L,_________(填“符合”或“不符合”)国家环保标准。(常温下,Ksp[Zn(OH)2]=1.2×10-17)
参考答案:(1)AD
(2)①10OH-+3ClO-+2Fe3+==3Cl-+2FeO42-+5H2O
(3)①FeO42-+4H2O+3e-=Fe(OH)3+5OH- ;②6.72;③78;不符合
本题解析:
本题难度:困难
5、填空题 如图,X和Y均为石墨电极:
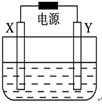
(Ⅰ)若电解液为滴有酚酞的饱和食盐水,电解反应的离子方程式为_____________;电解过程中____极(填“阴”或“阳”)附近会出现红色;
(Ⅱ)若电解液为500 mL含A溶质的某蓝色溶液,电解一段时间,观察到X电极表面有红色的固态物质生成,Y电极有无色气体生成;溶液中原有溶质完全电解后,停止电解,取出X电极,洗涤、干燥、称量,电极增重1.6 g。
(1)电解后溶液的pH为___;要使电解后溶液恢复到电解前的状态,需加入一定量的____(填加入物质的化学式)。(假设电解前后溶液的体积不变)
(2)请你推测原溶液中所含的酸根离子可能是____;并设计实验验证你的推测,写出实验的操作步骤、现象和结论:
参考答案:(Ⅰ) 阴
阴
(Ⅱ)(1)1 CuO或CuCO3
(2)硫酸根离子 取少量待测液于试管中,滴加盐酸无明显现象,继续加入氯化钡溶液,若有白色沉淀产生,则证明含硫酸根离子〔或:硝酸根离子 取少量待测液于试管中,加热浓缩后滴加浓硫酸和铜粉,若有红棕色气体产生,则证明含硝酸根离子〕
本题解析:(Ⅰ)该装置为电解饱和食盐水的装置,其电解反应的离子方程式为 ,在该电解池的阳极中生成了氯气,在阴极中生成了氢气和氢氧化钠,所以电解过程中在阴极附近会出现红色;(Ⅱ)若电解液为500 mL含A溶质的某蓝色溶液,电解一段时间,观察到X电极表面有红色的固态物质生成,则该红色物质为铜,该蓝色溶液含铜离子的溶液,电解该溶液,在阴极上析出铜单质,其电极反应为:
,在该电解池的阳极中生成了氯气,在阴极中生成了氢气和氢氧化钠,所以电解过程中在阴极附近会出现红色;(Ⅱ)若电解液为500 mL含A溶质的某蓝色溶液,电解一段时间,观察到X电极表面有红色的固态物质生成,则该红色物质为铜,该蓝色溶液含铜离子的溶液,电解该溶液,在阴极上析出铜单质,其电极反应为:
Cu2++2e-=Cu,在阳极上氢氧根放电生产了氧气,其电极反应为2H2O-4e-=O2↑+4H+,当电解结束后,电极增重1.6 g,即析出铜1.6g,通过的电子数为1.6/64×2=0.05mol,所以产生的氢离子的物质的量为0.05mol,所以c(H+)=0.05/0.5=0.1mol/L,所以pH=-lg0.1=1;要使电解后溶液恢复到电解前的状态,因为析出的是氧元素和铜元素,所以需加入一定量的CuO或CuCO3;(2)原溶液中所含的酸根离子可能是硫酸根离子,其验证的过程为:取少量待测液于试管中,滴加盐酸无明显现象,继续加入氯化钡溶液,若有白色沉淀产生,则证明含硫酸根离子。〔或:硝酸根离子 取少量待测液于试管中,加热浓缩后滴加浓硫酸和铜粉,若有红棕色气体产生,则证明含硝酸根离子〕
考点:电解池
点评:本题考查了电解池的知识,该知识点是高考考查的重点和难点,本题考查的知识比较全面,有利于考查学生对该知识的掌握情况,本题难度适中。
本题难度:一般