1、选择题 下列有关化学用语,表达正确的是
[? ]
A.Na2S的电子式: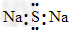 ?
?
B.铯-137:137Cs
C.O2-的结构示意图: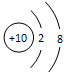 ?
?
D.乙烯分子的球棍模型: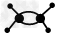 ?
?
参考答案:D
本题解析:
本题难度:简单
2、填空题 (1)主族元素A的简单阳离子不与任何原子具有相同的核外电子排布。元素B与氮元素同周期,B的原子序数大于氮,而第一电离能比氮的小。A与B能形成两种化合物A2B2和A2B,其中B的杂化方式分别为?、?。A2B、NH3、SiH4的键角由大到小依次为?(填化学式)。A2B由液态形成晶体时密度减小,主要原因是?。
(2)新型无机材料在许多领域被广泛应用。陶瓷发动机的材料选用氮化硅,它硬度大、化学稳定性强,是很好的高温陶瓷材料。除氢氟酸外,氮化硅不与其他无机酸反应,抗腐蚀能力强。氮化硅的晶体类型是?,氮化硅与氢氟酸反应的化学方程式为?。
(3)MgC03和CaC03都为离子晶体,热分解的温度分别为402℃和900℃,请根据结构与性质的关系说明它们热分解温度不同的原因:?。
(4)砷化镓广泛用于雷达、电子计算机、人造卫星、宇宙飞船等尖端技术中。镓的基态原子价电子排布式为?,砷化镓的晶胞结构与金刚石相似,其晶胞边长为a pm,则每立方厘米该晶体中所含砷元素的质量为?g(用NA表示阿伏加德罗常数)。
参考答案:(1)sp3(1分) sp,3(1分)SiH4>NH3>H2O(2分)形成晶体时,每个水分子与4个水分子形成氢键,构成空间正四面体网状结构,水分子的空间利用率低,密度反而减小(2分)
(2)原子晶体(1分)Si3N4+12HF=3SiF4+4NH3↑(2分)
(3)Mg2+半径小于Ca2+半径,故MgO晶格能大于CaO晶格能,所以Mg2+比Ca2+更易与碳酸根离子中的阳离子结合,使碳酸根离子分解为二氧化碳;(2分)
(4)4s24p1(2分) 3.00×1032/a3·NA(2分)
本题解析:(1) 主族元素A的简单阳离子不与任何原子具有相同的核外电子排布,则A是H元素,A与B能形成两种化合物A2B2和A2B且B为第二周期元素,所以B为O元素;化合物A2B2和A2B分别是H2O2、H2O,二者都是sp3杂化,SiH4、NH3、H2O的价层电子对都是4,但孤电子对数分别是0、1、2,价层电子对数相同时孤对越多键角越小,所以键角的大小顺序是SiH4>NH3>H2O;液态水的密度大于冰,是因为冰中的每个水分子与4个水分子形成氢键,构成空间正四面体网状结构,水分子的空间利用率低,密度反而减小;
(2)氮化硅硬度大、化学稳定性强,属于原子晶体;氮化硅与氢氟酸反应生成四氟化硅和氨气,化学方程式为Si3N4+12HF=3SiF4+4NH3↑;
(3)二者的阴离子都是碳酸根离子,阳离子不同,所以应比较阳离子的半径的不同所决定的离子键的强弱不同,Mg2+半径小于Ca2+半径,故MgO晶格能大于CaO晶格能,所以Mg2+比Ca2+更易与碳酸根离子中的氧离子结合,使碳酸根离子分解为二氧化碳;
(4)镓是第四周期ⅢA主族元素,最外层3个电子,所以其基态原子价电子排布式为4s24p1,砷化镓的晶胞结构与金刚石相似,所以砷化镓的晶胞中有4个砷原子,则1个晶胞中砷元素的质量是
4×75g/NA=300g/NA,晶胞的体积为(a×10-10)3cm3,所以每立方厘米该晶体中所含砷元素的质量为3.00×1032/a3·NAg。
本题难度:一般
3、选择题 下列说法中不正确的是?
[? ]
A.?含有配位键的化合物一定是配位化合物?
B.?配位键实质上是一种共价键
C.?配位键也是一种静电作用?
D.?配位键具有饱和性和方向性
参考答案:A
本题解析:
本题难度:简单
4、填空题 在下列化合物中:H2O 、Na2O、I2 、NaCl、KOH、CO2、NH4Cl、Na2O2,请填空:
(1)只由非金属组成的离子化合物是__________________,
(2)含有极性共价键的离子化合物是__________________,
(3)只含有非极性共价键的是__________________,
(4)既有离子键又有非极性键的化合物是__________________。
参考答案:(1)NH4Cl
(2)KOH、NH4Cl
(3)I2
(4)Na2O2
本题解析:
本题难度:一般
5、选择题 某品牌食品包装中放有一包用作干燥剂的生石灰,生石灰的主要成分是( )
A.CaCO3
B.Ca(OH)2
C.CaSO4
D.CaO
参考答案:D
本题解析:
本题难度:简单