1、选择题 实验室里需要480 mL 0.1mol/L的硫酸铜溶液,现选取500 mL容量瓶进行配制,以下操作正确的是[胆矾(CuSO4·5H2O)]
A.称取7.68 g硫酸铜,加入500 mL水
B.称取12.0 g胆矾配成500 mL溶液
C.称取8.0 g硫酸铜,加入500 mL水
D.称取12.5 g胆矾配成500 mL溶液
2、选择题 下列分离方法不正确的是
A.用过滤的方法除去食盐水中的泥沙
B.用蒸馏的方法将自来水制成蒸馏水
C.用酒精萃取碘水中的碘
D.用分液漏斗分离水和苯
3、选择题 下列实验装置和操作一般不用于分离物质的是( )
A.
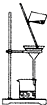
过滤
B.

定容
C.
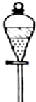
分液
D.
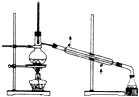
蒸馏
4、简答题 防止水体污染,改善水质,最根本的措施是控制工业废水和生活污水的排放.有一种工业废水,已知其中含有大量的Fe2+?和SO42-,少量的Ag+和Na+,以及部分污泥.某校化学兴趣小组同学通过下列操作过程,回收物质,处理废水.
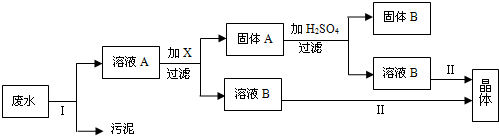
根据上述操作过程,回答下列问题:
(1)在实验室进行Ⅰ操作时,需要的主要玻璃仪器有______.
(2)操作Ⅱ的名称是______.
(3)向溶液A中需要加入过量X,X是______,发生反应的离子方程式为______.
(4)上述操作回收到的物质B是______,晶体是______.(两空均写名称)
5、填空题 工业上用粉碎的煤矸石(主要含Al2O3、SiO2及铁的氧化物)制备净水剂BAC〔Al2(OH)nCl6-n〕的流程如下:
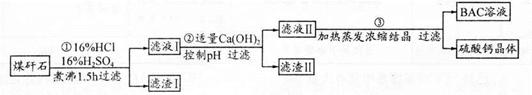
(1)粉碎煤矸石的目的是______;滤渣I的主要成分是______ (填化学式)。
(2)步骤①在煮沸的过程中,溶液逐渐由无色变为绿色,此时溶液中有色离子为______(填化学式);随后溶液又变为棕黄色,相关离子反应方程式为______;
步骤①的煮沸装置上方需安装一长导管,长导管的作用是____________。
(3)步骤②中加入适量的Ca(OH)2并控制pH,其目的:一是生成BAC;二是___________;巳知BAC的分散质粒子大小在1 nm?100 nm之间,由此区别滤液I与BAC两种液体的物理方法是______;若Ca(OH)2溶液过量,则步骤③得到的BAC产率偏低,写出该反应的离子方程式______。
(4)若0.1 molAlCl3在某温度下溶于蒸馏水,当有5℅水解生成Al(OH)3溶液时,吸收热量a kJ。写出该过程的热化学方程式____________。