1、选择题 下列离子方程式正确的是
A.溴化亚铁溶液中通入足量的氯气:2Fe2++Cl2=2Fe3++2Cl-
B.氨水中加入明矾溶液:3OH-+Al3+=Al(OH)3↓
C.铝片投入氢氧化钠溶液:2Al+2OH-+2H2O=2AlO2-+3H2↑
D.氯气溶于水:Cl2+H2O=2H++Cl-+ClO-
参考答案:C
本题解析:
本题难度:一般
2、选择题 下列说法正确的是
A.铝片与盐酸的反应是放热反应,且混乱度增大
B.如果反应物所具有的能量的总和高于生成物所具有的总能量,在发生反应时就会是吸热反应
C.ΔS>0,ΔH>0的化学反应低温下能自发进行
D.反应热(ΔH)=生成物键能总和-反应物键能总和
参考答案:A
本题解析:
本题难度:一般
3、选择题 已知NaAlO2溶液与NaHCO3溶液发生反应:H2O+AlO2-+HCO3-=Al(OH)3↓+CO32-。现向1 L含KOH、
Ba(OH)2、KAlO2的溶液中不断通入CO2气体,随着CO2的不断通入,溶液中离子的数目也相应地发生变化(如下图所示)。图中的a、b、c、d、e五条曲线与溶液中离子的对应关系,完全正确的是
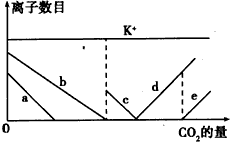
[? ]
a?
b
c
d
e
A.
Ba2+?
OH-
HCO3-
AlO2-
Ba2+
B.
OH-?
Ba2+
AlO2-
Ba2+
HCO3-
C.
Ba2+?
OH-
AlO2-
HCO3-
Ba2+
D.
Ba2+?
OH-
AlO2-
CO23-
HCO3-
参考答案:C
本题解析:
本题难度:一般
4、填空题 (6分)离子反应是中学化学中重要的反应类型。回答下列问题:
(1)人们常用图示的方法表示不同反应类型之间的关系。如分解反应和氧化还原反应可表示为下左图。下右图为离子反应、氧化还原反应和置换反应三者之间的关系,则表示离子反应、氧化还原反应、置换反应的字母分别是??。

(2)离子方程式是重要的化学用语。下列是有关离子方程式的一些错误观点,请在下列表格中用相应的“离子方程式”否定这些观点。
反应物从下列物质中选取:Na、Fe、H2O、H2SO4、HCl、NaOH、Ba(OH)2、CuCl2
?
| 错误观点
| 离子方程式
|
①
| 所有的离子方程式均可以表示一类反应
| ?
|
②
| 所有酸碱中和反应均可表示为:H++OH-=H2O
| ?
参考答案:(6分) (1) C? A? B? (2)?(每空2分)
?
错误观点
离子方程式
①
所有的离子方程式均可以表示一类反应
2Na+2H2O=2Na++2OH—+H2↑
②
所有酸碱中和反应均可表示为:H++OH-=H2O
2H++SO42—+Ba2++2OH—=Ba(OH)2↓+2H2O
本题解析:(1)凡是有元素化合价升降的反应都是氧化还原反应,而有离子参加的反应是离子反应,所以离子反应不一定是氧化还原反应,单元氧化还原反应也不一定是离子反应。一种单质与一种化合物反应,生成另外一种单质和另外一种化合物的反应是置换反应,因此置换反应一定是氧化还原反应,但不一定是离子反应,所以表示离子反应、氧化还原反应、置换反应的字母分别是C、A、B。
(2)①离子方程式不一定均可以表示一类反应,例如离子方程式2Na+2H2O=2Na++2OH—+H2↑就只能不是钠与水的反应。
②硫酸和氢氧化钡反应的化学方程式是H2SO4+Ba(OH)2=2H2O+BaSO4↓,离子方程式为2H++SO42—+Ba2++2OH—=Ba(OH)2↓+2H2O,所以所有酸碱中和反应均可表示为:H++OH-=H2O是错误的。
本题难度:一般
5、选择题 向含有1 mol HCl和1 mol MgSO4的混合溶液中加入1 mol/L Ba(OH)2溶液,下列图象能正确表示产生沉淀的物质的量(n)与加入Ba(OH)2溶液的体积(V)之间关系的是( )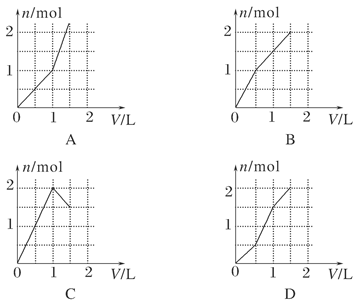
参考答案:D
本题解析:滴入Ba(OH)2将会发生H++OH-===H2O,Ba2++SO42-===BaSO4↓,Mg2++2OH-===Mg(OH)2↓,当加入0.5 mol Ba(OH)2时,盐酸耗完再滴入则既有BaSO4沉淀又有了Mg(OH)2沉淀;当加入Ba(OH)2 1 mol时SO42-沉淀完全;加入1.5 mol Ba(OH)2时,Mg2+又沉淀完全,故选D。
本题难度:一般
|