1、选择题 过氧化钠具有强氧化性,遇木炭、铝粉等还原性物质时可燃烧.下列有关说法不正确的是
A.过氧化钠晶体中,阴离子与阳离子的个数之比为1:1
B.熔融过氧化钠时不可使用石英坩埚
C.过氧化钠与木炭、铝粉反应时,过氧化钠均表现出强氧化性
D.过氧化钠与二氧化硫反应时可生成硫酸钠
参考答案:A
本题解析:分析:A、过氧化钠是由钠离子和过氧根离子构成;
B、过氧化钠会腐蚀石英坩埚;
C、Na2O2把Al粉强烈氧化甚至燃烧,过氧化钠氧化碳为二氧化碳;
D、过氧化钠具有氧化性,二氧化硫具有还原性,过氧化钠与二氧化硫反应会发生氧化还原反应.
解答:A、过氧化钠晶体中,过氧化钠是由钠离子和过氧根离子构成,阴离子与阳离子的个数之比为1:2,故A错误;
B、过氧化钠和二氧化硅反应,熔融过氧化钠时不可使用石英坩埚,故B正确;
C、过氧化钠具有强氧化性,铝、碳具有还原性,过氧化钠氧化铝、碳表现强氧化性,故C正确;
D、过氧化钠具有氧化性,二氧化硫具有还原性,过氧化钠与二氧化硫反应时可生成硫酸钠Na2O2+SO2=Na2SO4,故D正确;
故选A.
点评:本题考查了过氧化钠性质的应用分析,过氧化钠的强氧化性是解题关键,题目难度中等.
本题难度:困难
2、选择题 某溶液中可能存在Fe3+、Fe2+、I-、HCO3-、Cl?-、NO3-六种离子中的几种.现进行下列实验:
①取少量溶液滴加KSCN溶液,溶液呈血红色;
②另取少量原溶液滴加盐酸,溶液的棕黄色加深.
据此可以推断,该溶液中肯定不存在的离子是
A.I-、HCO3-、Cl-
B.Fe2+、HCO3-、NO3-
C.I-、HCO3-
D.Fe3+、I-、HCO3-
参考答案:C
本题解析:分析:Fe3+、Fe2+、I-、HCO3-、Cl?-、NO3-六种离子中,Fe3+用KSCN溶液检验,溶液呈血红色说明含有Fe3+,因Fe3+与I-能发生氧化还原反应,所以一定不存在I-,另取少量原溶液滴加盐酸,溶液的棕黄色加深,说明在酸性条件下原溶液中一定存在Fe2+、NO3-,Fe2+被氧化成三价铁离子,加酸没有气体生成,所以一定不存在HCO3-、据此即可解答.
解答:某溶液中可能存在Fe3+、Fe2+、I-、HCO3-、Cl?-、NO3-六种离子中的几种.现进行下列实验:
①取少量溶液滴加KSCN溶液,溶液呈血红色,发生3SCN-+Fe3+?Fe(SCN)3不能大量共存,说明原溶液中一定存在Fe3+,因Fe3+与I-能发生2Fe3++2I-=2Fe2++I2,所以一定不存在I-;
②另取少量原溶液滴加盐酸,溶液的棕黄色加深,发生3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,说明原溶液中一定存在Fe2+、NO3-,因HCO3-+H+=H2O+CO2↑所以原溶液滴加盐酸加酸没有气体生成,所以一定不存在HCO3-,无法确定是否含有Cl-;
故选C.
点评:本题考查离子的检验,注意把握离子反应的实验现象以及离子的检验的实验操作方法,题目难度不大.
本题难度:困难
3、选择题 下列是某学生自己总结的一些规律,其中正确的是
A.氧化物不可能是还原产物,只可能是氧化产物
B.一种元素可能有多种氧化物,但同种化合价只对应一种氧化物
C.饱和溶液一定比不饱和溶液的浓度大
D.有些化学反应不属于化合、分解、置换、复分解等类型中的任何一种
参 考答案:D
本题解析:分析:A、氧化物可能是还原产物,也可能是氧化产物;
B、一种元素同种化合价时对应的氧化物有可能不止一种;
C、饱和溶液还有一个温度的条件,饱和溶液不一定比不饱和溶液的浓度大,;
D、按照反应物和生成物的种数和类别,将化学反应分为化合、分解、置换、复分解四大类型.
解答:A、氧化物可能是还原产物,也可能是氧化产物,如反应2H2O2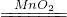 H2O+O2↑中,H2O就是还原产物,故A错误;
H2O+O2↑中,H2O就是还原产物,故A错误;
B、一种元素同种化合价时对应的氧化物有可能不止一种,如钠的氧化物有氧化钠和过氧化钠两种,故B错误;
C、饱和溶液不一定比不饱和溶液的浓度大,因为饱和溶液还有一个温度的条件,10°C下饱和溶液的浓度就不一定比100°C下不饱和溶液浓度大,故C错误;
D、类似H2S+O2=H2O+SO2的氧化还原反应不属于化合、分解、置换、复分解等类型中的任何一种,故D正确.
故选D.
点评:本题考查学生氧化还原反应的综合知识,要求学生具有分析和解决问题的能力,难度较大.
本题难度:一般
4、选择题 下列各组离子一定能大量共存的是
A.=0.1mol/L的溶液:Na+、K+、SiO32-、NO3-
B.在强碱溶液中:Na+、ClO-、AlO2-、CO32-
C.在c(OH-)=10-1mol?L-1的溶液中:NH4+、Al3+、SO42-、NO3ˉ
D.在pH=1的溶液中:K+、Fe2+、Cl-、NO3-
参考答案:AB
本题解析:分析:A.c(OH-)= =0.1mol/L,溶液呈碱性,在碱性条件下不发生反应的离子可共存;
=0.1mol/L,溶液呈碱性,在碱性条件下不发生反应的离子可共存;
B.强碱性溶液中存在大量的OH-,在碱性条件下不发生反应的离子可共存
C.c(OH-)=10-1mol?L-1的溶液呈碱性,NH4+、Al3+不能大量存在;
D.pH=1的溶液中Fe2+与NO3-发生氧化还原反应.
解答:A. =0.1mol/L,.c(OH-)=10-1mol?L-1,在碱性条件下离子之间不发生任何反应,可大量共存,故A正确;
=0.1mol/L,.c(OH-)=10-1mol?L-1,在碱性条件下离子之间不发生任何反应,可大量共存,故A正确;
B.Na+、ClO-、AlO2-、CO32-在碱性条件下发生任何反应,可大量共存,故B正确;
C.NH4+、Al3+与OH-反应而不能大量共存,故C错误;
D.pH=1的溶液中Fe2+与NO3-发生氧化还原反应而不能大量共存,故D正确.
故选AB.
点评:本题考查离子共存问题,题目难度不大,解答该类题目的关键是把握题目信息,学习中注意常见离子的性质.
本题难度:简单
5、选择题 下列各物质中,属于漂白粉有效成分的是
A.次氯酸
B.氯化钙
C.次氯酸钙
D.次氯酸钙和氯化钙
参考答案:C
本题解析:分析:漂白粉的主要成分是次氯酸钙和氯化钙,有效成分是次氯酸钙.
解答:漂白粉的有效成分是次氯酸钙,由于次氯酸的酸性比碳酸弱,次氯酸钙能与二氧化碳和水反应生成具有漂白性的次氯酸,而漂白粉的主要成分是次氯酸钙和氯化钙,故选:C.
点评:本题考查物质的组成,题目难度不大,注意相关基础知识的积累.
本题难度:困难