1、选择题 实验室中,要使偏铝酸钠溶液中的AlO2-离子全部沉淀出来,最适宜用的试剂是
A.NaOH溶液
B.CO2
C.盐酸
D.氨水
参考答案:B
本题解析:要使偏铝酸钠溶液中的AlO2-离子全部沉淀出来,则需要加入酸将其转化为氢氧化铝沉淀。但由于氢氧化铝是两性氢氧化物,能溶于酸或强碱溶液中,所以应该选择弱酸,例如碳酸等。A、氢氧化钠溶液显碱性,与AlO2-离子不反应,A不正确;B、CO2通入到含有AlO2-离子的溶液中生成氢氧化铝沉淀而析出,B正确;C、盐酸虽然能和AlO2-离子反应生成氢氧化铝,但过量的盐酸能溶解氢氧化铝,C不正确;D、氨水显碱性,与AlO2-离子不反应,D不正确,答案选B。
本题难度:一般
2、选择题 下表所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是
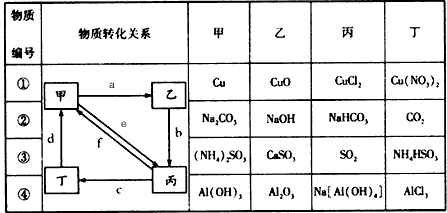
[? ]
A.①②③④
B.①②③
C.①③④
D.②④
参考答案:A
本题解析:
本题难度:简单
3、选择题 为测定某镁铝合金样品中铝的含量,进行了下列实验:取一定量合金,加入100 mL 0.3 mol·L-1稀硫酸,合金完全溶解,产生的气体在标准状况下体积为560 mL;再加入0.2 mol·L-1 NaOH溶液至沉淀质量恰好不再变化,用去350 mL NaOH溶液。则所取样品中铝的物质的量为
A.0.005 mol
B.0.010 mol
C.0.020 mol
D.0.030 mol
参考答案:B
本题解析:本题考查镁铝合金与酸、碱反应的计算,意在考查考生对镁、铝性质的理解及化学计算能力。沉淀质量恰好不再变化,得到NaAlO2和Na2SO4溶液,根据S元素守恒,n(SO42- )=n(H2SO4)=0.1 L×0.3 mol·L-1=0.030 mol,根据Na元素守恒,则n(Na+)=n(NaOH)=0.2 mol·L-1×0.35 L=0.070 mol,则n(AlO2-)=0.070 mol-0.030 mol×2=0.010 mol,根据Al元素守恒,n(Al)=n(AlO2-)=0.010 mol,B项正确。
本题难度:一般
4、填空题 向20 mL AlCl3溶液中滴入2 mol·L-1 NaOH溶液时,得到Al(OH)3沉淀质量与所滴加NaOH溶液体积(mL)关系如图所示:

(1)图中A点表示的意义是___________________________________________________。
(2)图中B点表示的意义是___________________________________________________。
(3)上述两步用总的离子方程式可表示为________________________。
(4)假若溶液中有Al(OH)3沉淀0.39 g,则此时用去NaOH溶液体积为______________。
参考答案:(1)表示滴入NaOH溶液产生沉淀量最大点
(2)表示滴入NaOH溶液沉淀恰好完全溶解点
(3)Al3+?+4OH-====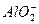 +2H2O
+2H2O
(4)7.5 mL或17.5mL
本题解析:把NaOH溶液滴入AlCl3溶液中,先产生Al(OH)3沉淀,其质量最大值(A点),来源:91考试网 91eXAm.org然后全部消失溶解(B点)。其总的反应离子方程式为:
Al3++4OH-====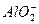 +2H2O
+2H2O
当有0.39 g Al(OH)3沉淀生成时,①AlCl3过量,加入NaOH使Al3+部分产生沉淀0.39 g,通过Al3++3OH-====Al(OH)3可知用NaOH7.5 mL。②当NaOH过量使Al3+全部参加反应生成Al(OH)3沉淀后又部分溶解,用NaOH 17.5 mL。
本题难度:简单
5、选择题 某同学通过系列实验探究铝及其化合物的性质,操作正确且能达到目的的是( )
A.将浓氨水缓慢滴入Al2(SO4)3溶液中,观察Al(OH)3沉淀的生成和溶解
B.将Al(OH)3浊液直接倒入已装好滤纸的漏斗中过滤,洗涤并收集沉淀
C.将Al(OH)3沉淀转入蒸发皿中,加热至无水蒸气逸出,得氧化铝固体
D.向Al(OH)3沉淀中分别加入稀硫酸和NaOH溶液探究Al(OH)3的两性
参考答案:D
本题解析:Al(OH)3不溶于氨水,A项错误;在过滤时,应沿玻璃棒倾倒液体,B项错误;应灼烧Al(OH)3固体得到Al2O3,C项错误。
本题难度:简单