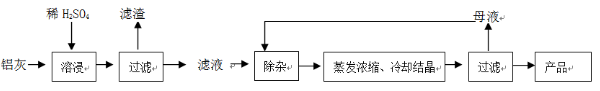
1、简答题 用含有A12O3、SiO2和少量FeO·xFe2O3的铝灰制备A12(SO4)3·18H2O。工艺流程如下:
 ?
?
(一定条件下,MnO4- 可与Mn2+反应生成MnO2)
已知: 生成氢氧化物沉淀的pH
?
| Al(OH)3
| Fe(OH)2
| Fe(OH)3
|
开始沉淀时
| 3.4
| 6.3
| 2.7
|
完全沉淀时
| 5.2
| 9.7
| 3.2
|
(1)H2SO4溶解A12O3的离子方程式是?;
(2)检验滤液中还存在Fe2+的方法是?(注明试剂、现象)。
(3)“除杂”环节有如下几个步骤:
(Ⅰ)向滤液中加入过量KMnO4溶液,调节溶液的pH为3.2;
(Ⅱ)加热,产生大量棕色沉淀,静置,上层溶液呈紫红色:
(Ⅲ)加入MnSO4至紫红色消失,过滤。
①步骤Ⅰ的目的?;调节溶液的pH为3.2的目的是?。
②向Ⅱ的沉淀中加入浓HCl并加热,能说明沉淀中存在MnO2的现象是?,写出其反应方程式?;
③Ⅲ中加入MnSO4的目的是?。
(4)从多次循环使用后母液中可回收的主要物质是?(填化学式)。
参考答案:(1)Al2O3+6H+=2Al3++3H2O
(2)取少量滤液,滴加KMnO4溶液,KMnO4溶液褪色
(3)①将Fe2+氧化为Fe3+;调节pH值使铁完全沉淀;
②有黄绿色气体生成;MnO2+4HCl ?MnCl2+ Cl2↑+2H2O
?MnCl2+ Cl2↑+2H2O
③除去过量的MnO4-。
(4)K2SO4。
本题解析:(1)硫酸溶解氧化铝生成硫酸铝和水,反应的离子方程式为:Al2O3+6H+=2Al3++3H2O;
(2)取少量滤液,滴加KMnO4溶液,KMnO4溶液褪色。
(3)①将Fe2+氧化为Fe3+,调节pH值使铁完全沉淀;
②加入浓盐酸与MnO2反应生成有黄绿色气体;MnO2+4HCl= MnCl2+ Cl2↑+2H2O
③MnO4-可与Mn2+反应生成MnO2,过滤除去,所以可以利用MnSO4的溶液和高锰酸钾溶液反应生成二氧化锰,把过量高锰酸根离子除去。
(4)多次循环的物质是K2SO4。
本题难度:一般
2、选择题 将等质量的两份硅-铝合金分别投入足量的稀盐酸和足量的氢氧化钠溶液中,(提示:硅和铝相似也能与氢氧化钠溶液反应放出氢气)充分反应后,测得产生的气体的体积比为3:7(相同状况下),则该合金中硅和铝的物质的量之比为( )
A.3:7
B.7:3
C.2:1
D.1:1
参考答案:设原混合物中含有xmolSi,ymolAl,
硅不与盐酸反应,只与NaOH溶液反应,
硅-铝合金投入足量的稀盐酸中,发生反应2Al+6HCl=2AlCl3+3H2↑,
生成氢气的物质的量为:n(H2)=1.5n(Al)=1.5ymol,
硅-铝合金投入足量的氢氧化钠溶液中:
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
1?3
y? 1.5y
Si+2NaOH+H2O=Na2SiO3+2H2↑
1? 2
x?2x
生成氢气的物质的量为:n(H2)=2xmol+1.5ymol,
根据题意可知:1.5y:(2x+1.5y)=3:7
解之得:x:y=1:1,
故选D.
本题解析:
本题难度:一般
3、选择题 用一张已除去表面氧化膜的铝箔紧紧包裹在试管外壁(如图),将试管浸入硝酸汞溶液中,片刻取出,然后置于空气中,不久铝箔表面生出“白毛”,红墨水柱右端上升。根据实验现象判断下列说法错误的是
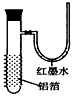
[? ]
A.实验中发生的反应都是氧化还原反应
B.铝是一种较活泼的金属
C.铝与氧气反应放出大量的热量
D.铝片上生成的白毛是氧化铝和氧化汞的混合物
参考答案:D
本题解析:
本题难度:一般
4、选择题 下列物质能跟镁反应并生成氢气的是(?)
A.盐酸溶液
B.氢氧化钠溶液
C.氯化铵溶液
D.碳酸钠溶液
参考答案:AC
本题解析:镁是活泼金属,可与热水、酸性溶液反应生成氢气。题目所给的四个选项中,A选项为酸溶液,Mg+2HCl====MgCl2+H2↑;C选项中氯化铵水解呈酸性,亦可与镁发生反应生成氢气,反应的离子方程式为Mg+2 ====Mg2++2NH3↑+H2↑。
====Mg2++2NH3↑+H2↑。
本题难度:简单
5、选择题 足量下列物质与等质量的铝反应,放出氢气且消耗溶质物质的量最少的是?(?)
A.氢氧化钠溶液
B.稀硫酸
C.盐酸
D.稀硝酸
参考答案:A
本题解析:首先铝与硝酸反应不放氢气,D错误,铝与剩余三种物质均可产生氢气。铝质量一定,当三种物质足量时,产生氢气的量相同,根据与三种物质反应后的产物的化学式(分别是NaAlO2、Al2(SO4)3、AlCl3)来判断,所用氢氧化钠物质的量最少,答案选A。
本题难度:一般