1、选择题 同温同压下,某容器充满O2重116g,若充满CO2重122g,现充满某气体重124g,则某气体的相对分子质量为
A.4
B.28
C.32
D.48
参考答案:D
本题解析:分析:同温同压下,气体的Vm相等,相同容器中气体的体积相等,则分子数、物质的量相等,根据n=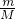 =计算.
=计算.
解答:同温同压下,气体的Vm相等,
相同容器中气体的体积相等,则分子数、物质的量相等,
设容器的质量为m,则
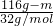 =
=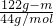 ,
,
m=100g,
设气体的摩尔质量为M,
则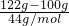 =
=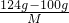
M=48g/mol,
所以相对分子质量为48,
故选D.
点评:本题考查阿伏加德罗定律及应用,题目难度不大,本题注意根据同温同压下,气体的Vm相等,相同容器中气体的体积相等,则分子数相等列方程式计算.建议把握相关计算公式及运用.
本题难度:一般
2、选择题 用NA表示阿伏加德罗常数,下列说法不正确的是( )
A.NA个氧气分子与NA个氖气分子的质量比是4:5
B.17gOH-与19gH3O+所含的电子数相等
C.16gCH4和17gNH3所含的质子数均为10NA
D.标准状况下,11.2L CO2与常温常压下8.5gNH3所含的分子数相等
参考答案:A.NA个氧气分子与NA个氖气分子的物质的量都是1mol,二者质量之比为32g:20g=8:5,故A错误;
B.17gOH-的物质的量为1mol,含有10mol电子,19gH3O+的物质的量为1mol,也含有10mol电子,二者含有的电子数相等,故B正确;
C.16gCH4的物质的量为1mol,含有10mol质子,17gNH3的物质的量为1mol,含有10mol质子,二者含有的质子数均为10NA,故C正确;
D.标准状况下,11.2L CO2的物质的量为0.5mol,8.5gNH3的物质的量为0.5mol,二者含有的分子数相等,故D正确;
故选A.
本题解析:
本题难度:简单
3、选择题 用NA表示阿伏加德罗常数的值。下列判断错误的是
[? ]
A.NA个H+的质量为1g
B.2 L 0.5mol/LNa2SO4溶液中含NA个Na+
C.32 g O2中含有2NA个O原子
D.标准状况下,1 mol H2O中含有NA个分子
参考答案:B
本题解析:
本题难度:简单
4、选择题 用NA表示阿伏加德罗常数的值,下列叙述不正确的是( )
A.标准状况下,22.4LCO2含有的分子数为NA
B.将10.6gNa2CO3溶于水,电离出Na+的数目为0.2NA
C.1molCuO被还原成Cu,得到电子数目为2NA
D.1L0.5mol/L的FeCl3溶液中,含有Cl-数目为0.5NA
参考答案:A、标准状况下,22.4LCO2的物质的量为1mol,含有的分子数为NA,故A正确;
B、10.6gNa2CO3的物质的量为10.6g106g/moL=0.1mol,则电离出Na+的数目为0.2NA,故B正确;
C、1molCuO被还原成Cu,Cu的化合价由+2价降到0价,得到电子数目为2NA,故C正确;
D、1L0.5mol/L的FeCl3溶液中,含有Cl-的物质的量为1L×0.5mol/L×3=1.5mol,Cl-数目为1.5NA,故D错误.
故选D.
本题解析:
本题难度:简单
5、简答题 下列叙述正确的是(NA为阿伏伽德罗常数)( )
A.标况下,22.4L苯的分子数为NA
B.48gO3气体含有NA个O3分子
C.0.5mol?L-1CuCl2溶液中含有0.5NA个Cu2+
D.标准状况下,22.4L氯气与足量氢氧化钠溶液反应转移的电子数为2NA
参考答案:A、标况下,苯是液体,所以不能使用气体摩尔体积计算,故A错误;
B、48g臭氧的物质的量是1mol,所以含有的分子数是NA,故B正确;
C、不知溶液的体积,无法计算,故C错误;
D、标况下,22.4L氯气的物质的量是1mol,发生反应时,转移的电子是1mol,所以电子数是NA,故D错误;
故选B.
本题解析:
本题难度:一般