1、选择题 有关下列各装置图的叙述,不正确的是
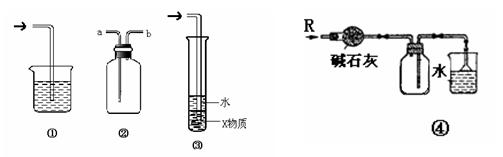
A.装置①可用于吸收实验中多余的Cl2
B.装置②可用于收集H2、NH3、Cl2、HCl、NO2等
C.装置③中X为苯,可用于吸收氨气或氯化氢
D.装置④可用于收集氨气,并吸收多余的氨气
参考答案:C
本题解析:略
本题难度:一般
2、实验题 (8分)某工厂废水中含游离态氯,通过下列实验测定其浓度。
①取水样10.00 mL于锥形瓶中,加入10.00 mL KI溶液(足量),滴入指示剂2—3滴。
②取一滴定管依次用自来水、蒸馏水洗净,然后注入0.01 mol·L-1Na2S2O3溶液(显碱性),调整液面,记下读数。
③将锥形瓶置于滴定管下进行滴定,发生的反应为:I2 + 2Na2S2O3?=" 2NaI" + Na2S4O6。
试完成下列问题:
(1)步骤①加入的指示剂是____________________。
(2)步骤②应使用____________式滴定管。
(3)步骤③当待测液由___________色变为__________色且不再变化即达终点,若耗去Na2S2O3溶液40.00 mL,则废水中Cl2的物质的量浓度为__________________________。
(4)以上实验步骤中有一处明显的操作错误,请指出.?
参考答案:

本题解析:略
本题难度:一般
3、实验题 (7分)(1)可以验证镁、铝的金属性强弱的实验是___________。
a.将在空气中放置已久的这两种元素的块状单质分别放入热水中
b.将这两种元素的单质粉末分别和同浓度的盐酸反应
c.将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液
d.比较这两种元素的气态氢化物的稳定性
(2)现有MgCl2溶液、AlCl3溶液、NaOH溶液、氨水、盐酸等几种物质,试设计实验方案证明镁、铝的金属性强弱。
参考答案:(1)bc
(2)分别取适量MgCl2溶液、AlCl3溶液于两支试管中,分别向两支试管中加入氨水,将所得沉淀等分为两份,分别向一份Mg(OH)2、Al(OH)3中加入适量NaOH溶液,不溶解的是Mg(OH)2,溶解的是Al(OH)3;再分别向另一份Mg(OH)2、Al(OH)3中加入适量盐酸,全部溶解,说明Mg的金属性比Al强。
本题解析:(1)判断金属性强弱,可根据金属与酸或水反应快慢,对应氢氧化物碱性强弱来判断。对于镁、铝可从与热水是否反应及与酸反应快慢来判断。
(2)由题给信息可知,应根据氢氧化铝的两性来判断。
本题难度:简单
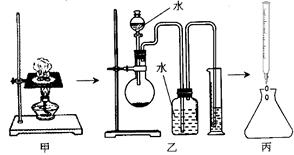
4、实验题 (12分)某学习小组利用下图所示装置进行“铁与水气反应”和其他实验(略去了夹持仪器)。

(1)为了安全,加热E以前必须进行的操作是____________________________。
(2) B中发生反应的化学方程式是?_______________。
(3)已知有反应:Cu2O+2H+ Cu+Cu2++H2O,则可用来检验反应后E中的红色固体中除Cu外是否含Cu2O,可用的试剂是________(填序号)
Cu+Cu2++H2O,则可用来检验反应后E中的红色固体中除Cu外是否含Cu2O,可用的试剂是________(填序号)
a.稀硝酸? b.稀硫酸? c.盐酸? d.浓硫酸?
(4)在E后若再接二个盛碱石灰的干燥管(依次称为F和G),则还可用该装置测定水的组成。若反应后盛有药品的E的质量减轻了e g,F的质量增加了f g。水中元素的物质的量之比可表示为(不用化简)n(H):n(O)= ________:_______;若反应后E中除Cu外还含有另一种还原产物Cu2O,则该比值将___________ (选填“偏大”“偏小”或“无影响”)。
(5)某学生为了检验反应后固体的成分,反应前在E管中加入了氧化铜固体16g,反应后称量固体的质量变为13.6g,则13.6g的成分为:___________(若为混合物,需计算出各自的质量)
参考答案:(12分)
⑴在E的出口收集氢气验纯(或检验装置内氢气的纯度)(2分)
⑵3Fe+4H2O(气) ?Fe3O4+4H2(2分)
?Fe3O4+4H2(2分)
⑶b、c(1分)
⑷f-e:e/16(2分);无影响(1分);
(5)铜6.4g,氧化亚铜7.2g(4分)
本题解析:略
本题难度:简单
5、实验题 某研究性学习小组对“钠在空气中燃烧的产物”进行了探究。其实验过程是:取一小块钠在空气中加热片刻后与一定量的水反应,收集到V mL气体(标准状况),将所得溶液用盐酸滴定恰好中和完全(如图所示)。
试回答:
(1)钠块在空气中易被氧化,因此实验室保存钠块应将其保存在盛有煤油的试剂瓶中,取出钠块的操作是用__________(填仪器名称)从试剂瓶中夹出一小块钠,做该探究实验之前,应对该钠块表面进行处理,目的是___________
(2)将已处理过的钠块放在图甲石棉网上加热,产生的现象是:①___________; ②____________;③产生白烟;④残留有白色固体。
(3)将已冷却的燃烧产物转移到图乙的烧瓶中,当滴入水时发生反应,产生的气体集中在集气瓶里,读取量筒读数时要注意三点:①待气体冷却后,②调节集气瓶与量筒液面持平,③____________。若V =168. 00 mL(标准状况),在一定条件下将其引燃,恰好完全反应。请将产生上述气体的固体成分及其质量填在下表:

(4)滴定之前,将乙中烧瓶内的液体(NaOH)全部转移到丙的_____________(仪器名称)中,转移的方法是:将烧瓶内的液体用玻璃棒引流倒入上述仪器中,再 ___________(填操作),待冷却后滴入几滴甲基橙指示剂,用盐酸进行滴定,终点现象是___________。若滴入盐酸浓度为0.40 mol/L,消耗的体积为75. 00 mL,则原来取出的纯净Na 的质量为___________克。
参考答案:(1)镊子 ;去除表面煤油及氧化物
(2)①钠块熔化成小球 ;②燃烧时火焰呈黄色
(3)③平视使视线与量筒液体凹液面最低点持平;
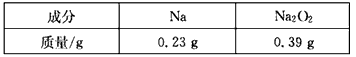
(4)锥形瓶 ;洗涤烧瓶和玻璃棒2~3次,洗涤液全部转入锥形瓶中 ;最后一滴刚好使溶液由黄色变橙色,且30秒钟不褪去 ;0. 69
本题解析:
本题难度:一般