1、填空题 碱式碳酸镁有多种不同的组成,如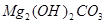 、
、 、
、 等。请你设计一个测定碱式碳酸镁组成的实验方案。包括
等。请你设计一个测定碱式碳酸镁组成的实验方案。包括
(1)测定原理
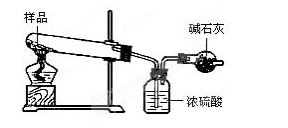
(2)测定实验的装置图
(3)操作步骤。
可使用的仪器、试剂和用品如下:
仪器:天平(附砝码)、大试管(附带有短玻璃管的橡皮塞)、酒精灯、洗气瓶、球形干燥管(附带有短玻璃管的橡皮塞)、铁架台、铁夹、角匙。
试剂:碱式碳酸镁(粉状)、浓硫酸、石灰水、无水氯化钙、碱石灰。
其他:火柴、棉花、短橡皮管、弹簧夹。
注意:①上述仪器和试剂只需应用其中的一部分。②仪器、试剂、用品的数量不限。
参考答案:(1)通过测定MgO、CO2、H2O的物质的量之比来测定碱式碳酸镁的组成。
(2)测定实验的装置如下图所示:
 ?
?
(3)操作步骤
① 将装置按上图连接好后,检查装置的气密性
② 称取一定量(W1g)样品于大试管中
③ 加热,至样品完全分解
④ 实验结束后,称量洗气瓶和干燥管的增重(设为W2、W3)
⑤ 计算MgO、CO2、H2O的物质的量之比为
n(MgO):n(CO2):n(H2O)=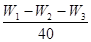 :
: :
: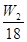 ?确定碱式碳酸镁的组成。
?确定碱式碳酸镁的组成。
本题解析:
【错解分析】考查测定碱式碳酸镁组成的实验方案设计。
【正解】可加热碱式碳酸镁,通过测定生成的MgO、CO2、H2O的物质的量之比来确定碱式碳酸镁的组成。用浓硫酸吸收H2O,根据浓硫酸增重的量,求出水的物质的量;用碱石灰吸收CO2,根据碱石灰的增重,确定CO2物质的量。
本题难度:简单
2、选择题 根据下列实验设计及有关现象,所得结论不正确的是
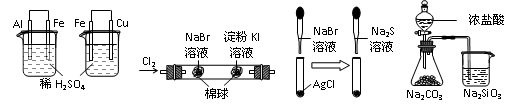
A?B?C?D
实 验
| 实验现象
| 结 论
|
A
| 左烧杯中铁表面有气泡,右边烧杯中铜表面有气泡
| 活动性:Al>Fe>Cu
|
B
| 左边棉花变为橙色,右边棉花变为蓝色
| 氧化性:Cl2>Br2>I2
|
C
| 白色固体先变为淡黄色,后变为黑色(Ag2S)
| 溶解性 :AgCl>AgBr>Ag2S
|
D
| 锥形瓶中有气体产生,烧杯中液体变浑浊
| 酸性:HCl>H2CO3>H2SiO3
参考答案:BD
本题解析:
答案:BD
B、右边棉花变为蓝色,发生的反应有两种可能:Cl2+2I―=2Cl―+I2? Br2+2I―=2Br―+I2
D、烧杯中液体变浑浊,也可能是2HCl+Na2SiO3=H2SiO3+2NaCl.
本题难度:简单
3、实验题 医用氯化钙可用于生产补钙、抗过敏和消炎等药物。以工业碳酸钙(含有少量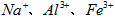 等杂质)生产医药级二水合氯化钙( 等杂质)生产医药级二水合氯化钙(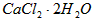 的质量分数为97.0%~103.0%)的主要流程如下 的质量分数为97.0%~103.0%)的主要流程如下

(1)除杂操作是加入氢氧化钙,调节溶液的pH为8.0~8.5,以除去溶液中的少量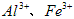 。检验 。检验 是否沉淀完全的试验操作是___________________。 是否沉淀完全的试验操作是___________________。
(2)酸化操作是加入盐酸,调节溶液的约pH为4.0,其目的有:
①将溶液中少量的 转化为 转化为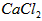 ; ;
②防止 在蒸发时水解; 在蒸发时水解;
③___________________。
(3)测定样品中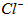 含量的方法是: 含量的方法是:
a.称取0.7500g样品,溶解,在250mL容量瓶中定容;
b.量取25.00mL待测溶液于锥形瓶中;
c.用0.05000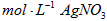 溶液滴定至终点,消耗 溶液滴定至终点,消耗 溶液体积的平均值为20.39mL。 溶液体积的平均值为20.39mL。
①上述测定过程中需要溶液润洗的仪器有___________________。
②计算上述样品中 的质量分数为___________________。 的质量分数为___________________。
③若用上述办法测定的样品中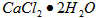 的质量分数偏高(测定过程中产生的误差可忽略),其可能原因有__________________;___________________。 的质量分数偏高(测定过程中产生的误差可忽略),其可能原因有__________________;___________________。
参考答案:(1)取少量上层清液,滴加KSCN溶液,若不出现血红色,则表明Fe(OH)3沉淀完全
(2)防止溶液吸收空气中CO2
(3)①酸式滴定管;②99.9%;③样品中存在少量的NaCl;少量的CaCl2·2H2O失水
本题解析:
本题难度:一般
4、选择题 下列不能达到实验目的的是
序号
| 实验内容
| 实验目的
| A
| 用石墨电极电解Mg(NO3)2、Cu( NO3)2的混合液
| 比较确定铜和镁的金属活动性强弱
| B
| 测同温同浓度Na2CO3和Na2SiO3水溶液的pH
| 确定碳和硅两元素非金属性强弱
| C
| 室温下,用pH试纸测定浓度为0.1mol·L-1NaClO溶液和0.1mol·L-1CH3COONa溶液的pH
| 比较HClO和CH3COOH的酸性强弱
| D
| 室温下,分别向2支试管中加入相同体积、相同浓度的Na2S2O3溶液,再分别加入相同体积不同浓度的稀硫酸
| 研究浓度对反应速率的影响
|
?
参考答案:C
本题解析:A、根据金属阳离子在阴极放电的先后顺序可以判断金属活动性强弱,铜离子先放电,金属铜活动性就弱,正确;B、根据“越弱越水解”盐类水解规律,最高价含氧酸的酸性越弱其对应的酸根离子水解程度越大,pH越大,进一步推出其非金属性越弱,正确;C、用pH试纸测定浓度为0.1mol·L-1NaClO,最终试纸漂白,实验达不到目的,错误;D、控制单一变量法,改变浓度,能够达到实验目的,正确。
本题难度:一般
5、简答题 某活动课程小组拟用50mL?NaOH溶液吸收CO2气体,制备Na2CO3溶液.为了防止通入过量的CO2气体生成NaHCO3,设计了如下实验步骤:
a.取25mL?NaOH溶液吸收过量的CO2气体,至CO2气体不再溶解;
b.小火煮沸溶液1~2min,赶走溶解在溶液中的CO2气体;
c.在得到的溶液中加入另一半(25mL)NaOH溶液,使其充分混合反应.
(1)此方案能制得较纯净的Na2CO3,写出c步骤的离子方程式______.此方案第一步的实验装置如下图所示:
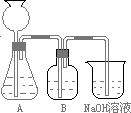
(2)加入反应物前,如何检验整个装置的气密性:______
(3)若用大理石与盐酸制CO2,则装置B中盛放的试剂是______,作用是______
(4)在实验室通常制法中,装置A还可作为下列______(填序号)气体的发生装置.
①HCl ②H2 ③Cl2 ④NH3
(5)已知所用NaOH溶液中溶质的质量分数为40%,室温下该溶液密度为1.44g/mL,假设反应前后溶液的体积不变,不考虑实验误差,计算用此种方法制备所得Na2CO3溶液的物质的量浓度为______?mol/L.
参考答案:(1)碳酸氢钠能和氢氧化钠反应生成碳酸钠和水,反应离子方程式为HCO3-+OH-═CO32-+H2O.
故答案为:HCO3-+OH-═CO32-+H2O.
(2)用止水夹夹住B、与烧杯之间的乳胶管,然后从漏斗中注入一定量的水,在装置内密封气体,使漏斗中的水面高于锥形瓶内的水面,过一会,观察漏斗内与锥形瓶中的液面差,若保持不变,说明装置不漏气.
故答案为:用止水夹夹住B、与烧杯之间的乳胶管,然后从漏斗中注入一定量的水,使漏斗中的水面高于锥形瓶内的水面,过一段时间,观察漏斗内与锥形瓶中的液面差,若保持不变,说明装置不漏气.
(3)盐酸易挥发,制取的二氧化碳含有HCl,B中盛放饱和碳酸氢钠溶液,吸收HCl气体,同时生成二氧化碳.
故答案为:饱和碳酸氢钠溶液;吸收HCl气体.
(4)该制取装置适合不加热制取气体,HCl、Cl2、NH3的制备都需要加热,不能使用该装置制备,制取H2不需要加热,可以选用该装置.
故答案为:②.
(5)m(NaOH)=50mL×1.44g/mL×40%=28.8g,所以n(NaOH)=28.8g40g/mol=0.72mol,根据钠元素守恒可知,溶液中n(Na2CO3)=12n(NaOH)=0.36mol,故c(Na2CO3)=0.36mol0.05L=7.2?mol/L.
故答案为:7.2?mol/L.
本题解析:
本题难度:一般
|